أول محاولة لجعل تقنية تحرير الجينات كريسبر تعمل في الحيوانات المنوية
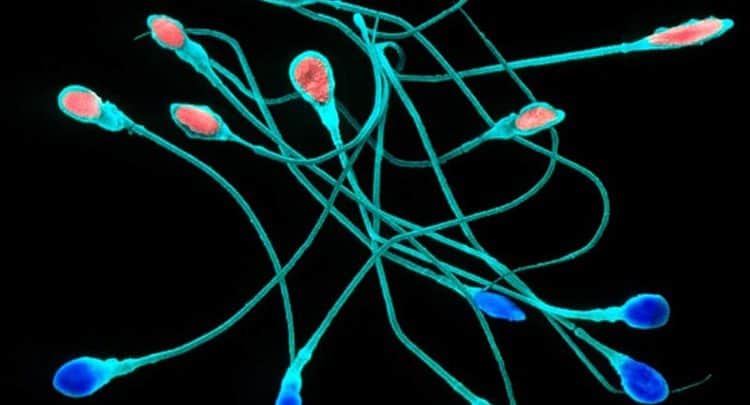
لأول مرة، يُحاول علماء الأحياء استخدام آلية كريسبر CRISPR لتحرير الجينات مباشرة في الحيوانات المنوية البشرية الناضجة، وليس في الأجنة المُخصَّبة. ولا يزال العمل في مرحلة مبكرة، ولكن قد يؤدي إلى طريقة جديدة لمنع الأمراض الوراثية.
وقد استخدم نحو ستة فرق طريقة كريسبر كاس 9 (CRISPR-Cas9) لتحرير الجينوم لتغيير الحمض النووي DNA في نواة الأجنة البشرية، ولكن لا يزال من غير الواضح ما إذا كان هذا النهج آمنًا لتصحيح الجينات المعيبة. وإحدى المسائل هي أنّ الانقسام الخلوي قد يبدأ قبل إصلاح الحمض النووي، مما يعني أن الجين تغيَّر في بعض الخلايا في الجنين النامي وليس جميعها. وهذه الظاهرة تسمى التَّزَيُّق الجيني Mosaicism.
لذا فإن ديان تشوي Diane Choi وزملاؤها، من كلية طب وايل كورنيل Weill Cornell Medicine في نيويورك، تجرِّب استخدام آلية كريسبر لإيصال ترميز الحمض النووي DNA إلى خلايا الحيوانات المنوية الناضجة بدلاً من الأجنة. وفي يوم الثلاثاء الماضي، أعلن الباحثون أنهم ربما وجدوا طريقة لفعل ذلك وتسمح للحيوانات المنوية بالبقاء سليمة نسبياً وقادرة على تخصيب البويضات.
“من الناحية النظرية، كل اضطرابات الجينات الأحادية التي ينقلها الذكور يمكن علاجها إذا كنا قادرين على استخدام كريسبر-كاس 9 بنجاح على الحيوانات المنوية،” كما تقول تشوي التي عرضت نهجها في مؤتمر الجمعية الأوروبية للتناسل البشري وعلم الأجنة European Society of Human Reproduction and Embryology conference في برشلونة بإسبانيا.
“ما زال هناك الكثير لنفهمه ونكتشفه عن الحيوانات المنوية، مما يجعل عملية تحرير الجينات أمرًا صعبًا”
وقد يكون من الممكن استخدام مثل هذا التحرير الجيني لمنع الآباء من توريث مجموعة واسعة من الاضطرابات الوراثية. فعلى سبيل المثال، قد يتمكن شخصان يعانيان اضطرابا كالتليف الكيسي cystic fibrosis أو فقر الدم المنجلي sickle cell anemia من إنجاب طفل سليم.
ولا يزال العمل في مرحلة مبكرة، ومع ذلك، فإنّ على فريق تشوي إثبات ما إذا كانت آلة تحرير الجينات تعمل داخل الحيوانات المنوية.
“إذا تمكنا من إجراء عملية التحرير في الحيوانات المنوية، فسيكون هذا أمرًا رائعًا. مع مراعاة كلمة إذا،” كما يقول توني بيري Tony Perry، من جامعة باث University of Bath في المملكة المتحدة، وهو باحث رائد في تقنية كريسبر ولم يشارك في هذا العمل الأخير ويُضيف قائلا: “أعتقد أنه أمر غير محتمل، لكنني أريد أن أكون مخطئا.”
وإحدى الطرق لادخال الحمض النووي داخل الخلايا هو صعقها بالكهرباء. وتكمن الصعوبة مع الحيوانات المنوية، الملفوفة في إهاب صلب وقاسي، في القيام بذلك دون التسبب بعجزها. ويقول الفريق أنّ نبضة كهربائية واحدة تبلغ 1100 فولت، أي ما يعادل واحدا على خمسين فقط من الثانية، كافية، على الرغم من أنها تقلل من قدرة الحيوانات المنوية على الحركة بمقدار النصف. لذا، اختار الفريق أولاً الحيوانات المنوية الأقوى والأكثر صحة قبل صعقها. وهذا يعني أنّ الحيوانات المنوية الناتجة لا تزال سبّاحة جيدة بما يكفي لتُستخدم في التلقيح الاصطناعي IVF، بدلا من الحاجة إلى حقنها في البويضة.
والسؤال الكبير هو ما سيحدث بعد ذلك. إذ إنّ إيصال الحمض النووي بآلية كريسبر إلى الخلية ليس إلّا أولى الخطوات العديدة اللازمة لإيجاد وتغيير الحمض النووي للجين بنجاح. وليس من الواضح حتى الآن ما إذا كان أي من الخطوات اللاحقة يمكن أن تحدث في الحيوانات المنوية.
وعلى سبيل المثال، الحمض النووي للحيوانات المنوية معبأ بإحكام، ومن ثم قد لا تكون أجزاء كريسبر قادرة على البحث خلاله للعثور على الجين الهدف إلا بعد أن يخصب الحيوانُ المنوي البويضةَ. ويعني هذا أنّ خطر التَّزَيُّق الجيني سيستمر، على الرغم من أنّ ذلك لن يكون مهمًا عند معالجة بعض الحالات.
وتقول تشوي: “لا يزال هناك الكثير اللازم لفهم واكتشاف الأمور حول نواة الحيوانات المنوية، مما يجعل مشروعنا أكثر صعوبة.”
ويقول بيري إنّ العديد من الفرق حول العالم حاولوا جاهدين تعديل الحيوانات المنوية الناضجة جينيا باستخدام التقنيات القديمة، دون نجاح. ولكن لم يحاول أي أحد آخر مع كريسبر، حسب علمه. فرانك سوين Frank Swain من برشلونة.





