نتيجة سيئة جدًا للدواء ريمديسفير
إدارة الغذاء والدواء وأوروبا صنفتاه كعلاج رئيس على الرغم من أن دراسة كبرى وجدت أن فائدته قليلة جدا

تغطية مجلة ساينس Science لأخبار كوفيد-19 يدعمها مركز بوليتزر Pulitzer Center ومؤسسة هايزنغ-سيمونز Heising-Simons Foundation.
بقلم: جون كوهين، كاي كفرشميدت
ترجمة: مي بورسلي
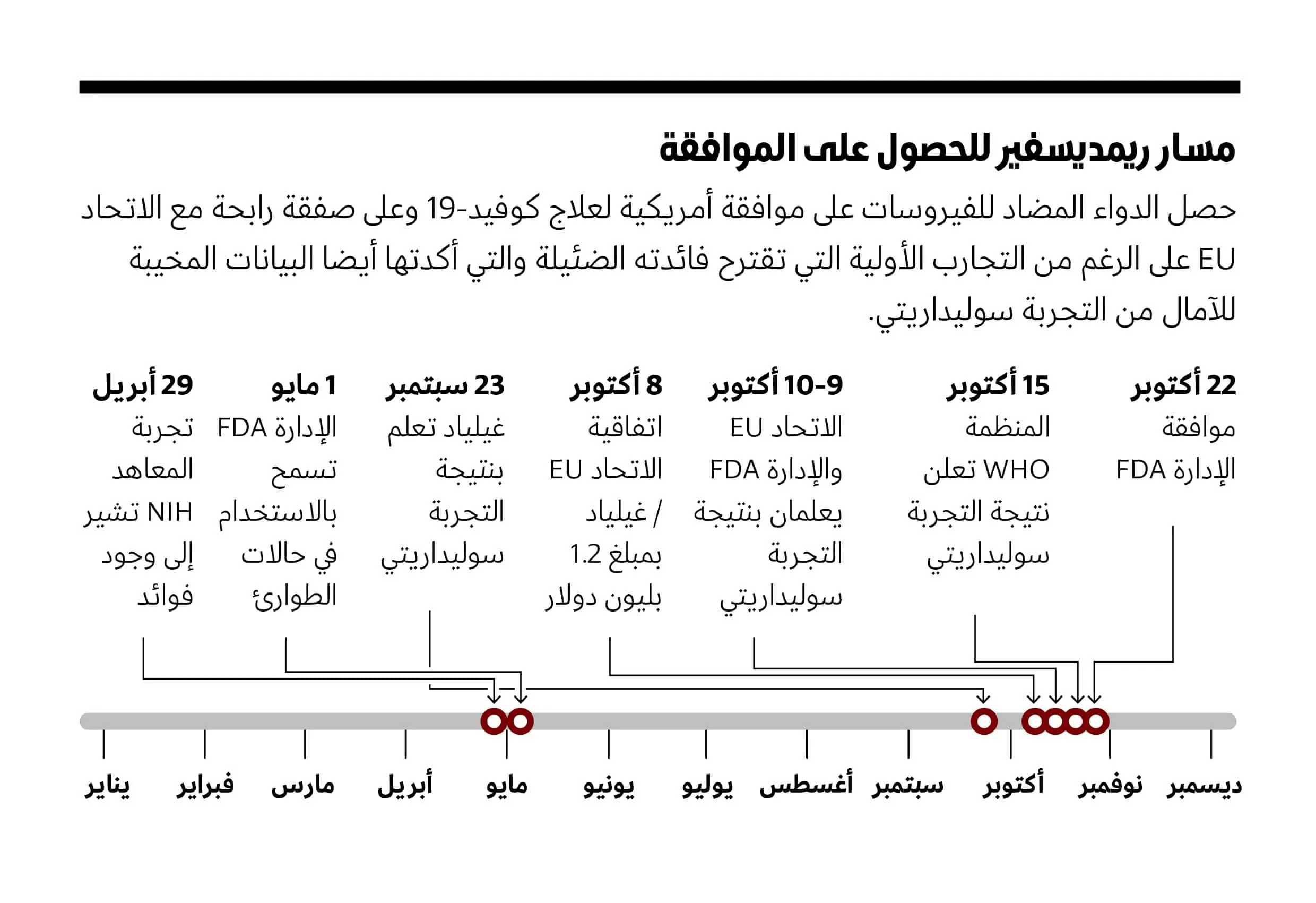
كان أكتوبر شهرًا جيدًا لشركة Gilead Sciences غيلياد ساينسيس، الشركة الأمريكية العملاقة للأدوية المضادة للفيروسات. ففي 8 أكتوبر وقعت الشركة اتفاقية لتزويد الاتحاد الأوروبي European Union (اختصارا: الاتحاد EU) بدواء ريمديسفير Remdesivir كعلاج لمرض كوفيد-19 ( COVID-19 )، صفقة يحتمل أن تزيد قيمتها على بليون دولار. وفي 22 أكتوبر صار ريمديسفير أول دواء معتمد من إدارة الغذاء والدواء الأمريكية Food and Drug Administration (اختصارا: الإدارة FDA) لعلاج كوفيد-19. وهذه القرارات تعني أن شركة غيلياد يمكنها تحقيق أرباح كبيرة في سوقين رئيسيتين، مع ارتفاع حالات الإصابة بكوفيد-19.
ولكنهم حيروا العلماء الذين راقبوا عن كثب التجارب الإكلينيكية (السريرية) لريمديسفير وهي تتكشف خلال الأشهر الستة الماضية، والذين لديهم العديد من الأسئلة حول فائدته كعلاج. ففي أحسن الأحوال وجدت دراسة كبيرة جيدة التصميم أن الريمديسفير الذي يجب حقنه في الوريد كان قد قلل قليلا من وقت التعافي جراء الإصابة بكوفيد-19 في المرضى الراقدين في المستشفى ممن هم في الحالة الشديدة من المرض. ولم تجد بعض الدراسات الأصغر أي تأثير في المرض على الإطلاق، ولم تجد أيٌّ منها أن مضاد الفيروسات قلل من مستوى الفيروس سارس-كوف-2 ( SARS-CoV-2)، وهو الفيروس المسبب للمرضى. وبعد ذلك، في 15 أكتوبر، قدمت الدراسة الرابعة والأكبر ما يعتقد البعض أنه انقلاب كبير ضد العِقار: أظهرت تجربة سوليداريتي (التضامن) Solidarity العملاقة لمنظمة الصحة العالمية World Health Organization (اختصارا: المنظمة WHO) أن الريمديسفير لا يقلل من الوفيات أو الوقت الذي يستغرقه المرضى المصابين بكوفيد-19 للتعافي.
وعلمت مجلة ساينس Science أن قرار الإدارة FDA واتفاق الاتحاد EU جاء في ظروف غير اعتيادية أعطت الشركة مزايا مهمة. ولم تستشر الإدارة FDA قطٌّ مجموعة من الخبراء الخارجيين ممن لديهم الاستعداد للتدخل فيما يتعلق بالأدوية المضادة للفيروسات المعقدة. ويمكن للإدارة FDA الاستفادة من تلك المجموعة؛ اللجنة الاستشارية للأدوية المضادة للميكروبات Antimicrobial Drugs Advisory Committee (اختصارا: اللجنة AMDAC)، لمراجعة جميع البيانات المتاحة حول العلاجات التجريبية، ومن ثم تقديم توصيات حول الموافقات على الأدوية – ومع ذلك لم تجتمع مرة واحدة أثناء الجائحةPandemic .
وفي غضون ذلك وافق الاتحاد EU على سعر شراء ريمديسفير قبل أسبوع واحد بالضبط من صدور نتائج التجربة سوليداريتي المخيبة للآمال. ولم يكن الاتحاد EU على علم بهذه النتائج، لكن شركة غيلياد علمت بأن التجربة كانت فاشلة؛ إذ بدأت بمراجعة البيانات في 23 سبتمبر 2020.
ويقول إريك توبول Eric Topol، الاختصاصي بأمراض القلب من معهد سكريبس للأبحاث الانتقالية Scripps Research Translational Institute: “هذا أمر سيئ جدًا للإدارة FDA، كما أن التعاملات بين شركة غيلياد والاتحاد EU يزيدها سوءًا”.
وليس لدى الإدارة FDA أي التزام لعقد اجتماع الجنة لاتخاذ قراراتها، كما يؤكد ديفيد هاردي David Hardy، العضو في اللجنة AMDAC، الاختصاصي بعلم فيروس HIV / الإيدز AIDS من جامعة كاليفورنيا في لوس أنجلوس. ومع ذلك، فإن هاردي “مندهش” لأن الإدارة لم تستشره في هذه الحالة. ويقول: “إن مثل هذا يضع أول معيار لمضادات لفيروسات لكوفيد-19…وهو حقًا شيء مهم جدًا”.
ولم تستجب الإدارة FDA لطلب مجلة ساينس لمناقشة سبب اختيارها عدم عقد اجتماع للجنة، مشيرة فقط إلى أن ذلك “يخضع لتقدير” مديري الأقسام. ولكن تقاعس الإدارة FDA يبرز في تناقض حاد مع طريقة تعاملها مع لقاحات كوفيد-19؛ فقد عقدت مجموعة استشارية لمناقشة المُعضِلات المحتملة في يوم الموافقة على ريمديسفير. وتقر شركة غيلياد من جانبها بأنها شاهدت مسودة أولية لنتائج التجربة سوليداريتي قبل التوقيع على اتفاق الإدارة FDA. ولكن شركة غيلياد تتحدى بقوة صحة البيانات، ويرجع ذلك جزئيًا إلى أن الدراسة أُجريت في بلدان ذات معايير رعاية صحية متنوعة تنوعا واسع النطاق.
وقد أثار هذا النقد غضب المشرفين على التجربة سوليداريتي. إذ تشير المنظمة WHO إلى أن نصف المرضى الذين عولجوا باستخدام ريمديسفير كانوا في أوروبا وكندا، ولم يكن الآخرون بالضرورة في بلدان ذات رعاية صحية متدنية المستوى. وتقول ماري- بول كيني Marie-Paul Kieny، مديرة الأبحاث في وكالة الأبحاث الطبية الفرنسية French medical research agency (اختصارا: الوكالة INSERM)، والتي كانت مسؤولة سابقة في المنظمة WHO: “إنه لأمر مُروِّع أن نرى الكيفية التي تحاول بها شركة غيلياد تشويه التجربة سوليداريتي”.
الآمال التي تلاشت
في العاشر من يناير نشر باحثون دراسة مشجعة في الدورية نيتشر كوميونيكيشنز Nature Communications حول ريمديسفير بعد يومين من اكتشاف الصين أن الفيروس سارس-كوف-2 يسبب مرض كوفيد-19، والذي طور في الأصل لمحاربة فيروسات الإيبولا Ebola والتهاب الكبد- سي Hepatitis-C. وفي كل من دراسات أنبوب الاختبار والفئران كانت له تأثيرات مثبطة قوية في فيروس قريب من سارس-كوف-2 الذي يسبب متلازمة الشرق الأوسط التنفسية Middle East Respiratory Syndrome. وبعد أسبوعين عالج الأطباء أول حالة مؤكدة في الولايات المتحدة بالدواء وأفادوا أن الرجل البالغ من العمر 35 عامًا قد تحسن بسرعة.
وقد أظهر تحليل مؤقت من تجربة إكلينيكية واسعة النطاق، أجرتها المعاهد الوطنية للصحة National Institutes of Health (اختصارا: المعاهد NIH) وأعلن عنها في 29 أبريل، أن الدواء قلل من متوسط وقت الشفاء لمرضى كوفيد -19 ذوي الحالة الشديدة ممن رقدوا في المستشفى من 15 يومًا إلى 11 يومًا. وظهرت دراسة ثانية، في الصين، في اليوم نفسه ولم تجد أي فائدة ذات دلالة إحصائية. وبعد يومين منحت الإدارة FDA ترخيصًا للاستخدام في حالات الطوارئEmergency Use Authorization (اختصارا: الإذن EUA) سمح بإعطاء الدواء في حالة كوفيد-19 الشديدة، وهي خطوة أشاد بها الرئيس دونالد ترامب Donald Trump في مؤتمر صحافي في المكتب البيضاوي مع دانيال أوداي Daniel O’Day، الرئيس التنفيذي لشركة غيلياد.
ولكن الإشارات المختلطة حول فاعلية الدواء استمرت بالورود: في أغسطس أظهرت دراسة برعاية شركة غيلياد أن المرضى الذين يعانون التهابا رئويا معتدلا وعولجوا لمدة خمسة أيام باستخدام ريمديسفير قد تحسنوا بسرعة أكبر من أولئك الذين تلقوا رعاية عادية، ولكن الغريب أن أولئك الذين عولجوا لمدة عشرة أيام لم يتحسنوا. ومع ذلك، وبعد فترة وجيزة، وسعت الإدارة FDA نطاق الإذن EUA لريمديسفير ليشمل جميع مرضى كوفيد-19 في المستشفى.
وبالنسبة إلى الاختصاصي توبول، فإن تحرك الإدارة FDA يشبه انتقادات شديدة لاستخدام الأذونات EUAs التي صدرت سابقًا لدواء الملاريا هيدروكسي كلوروكوين Hydroxychloroquine- الذي ألغته الإدارة لاحقًا – وبلازما “النقاهة” Convalescent plasma الغنية بالأجسام المضادة. وفي رسالة مفتوحة إلى ستيفن هان Stephen Hahn، مفوض الإدارة FDA، كتب: “تظهر هذه الانتهاكات المتكررة استعدادك لتجاهل نقص الأدلة العلمية، والتواطؤ مع تسييس إدارة ترامب لمؤسسات الرعاية الصحية الأمريكية”.
والعديد من العلماء توقع أن تحدد التجربة سوليداريتي التابعة للمنظمة WHO – التي شملت 2750 مريضًا تلقى دواء ريمديسيفير، أي ما يقرب من ثلاثة أضعاف جميع التجارب المنشورة الأخرى مجتمعة – فائدة الدواء. وقد أجريت في 30 دولة وقارنت مجموعة سوليداريتي دواء ريمديسفير وثلاثة أدوية أخرى مُعَاد استخدامها ببعضها البعض وبمعايير الرعاية. (على عكس تجارب المعاهد NIH والتجارب الصينية، لم تستخدم الدواء الغفل (الوهمي) Palcebo). ولم تقلل أي من الأدوية من معدل الوفيات بين المرضى في المستشفى، كما وجدت، ولاحظ المحققون أيضًا أن دواء ريمديسفير لم يؤثر في “مدة المكوث في المستشفى” أو ما إذا كان مرضى كوفيد-19 يحتاجون إلى أجهزة التنفس الصناعي.
وفي العاشر من أكتوبر قدمت التجربة سوليداريتي النتائج إلى ممثلي الإدارة FDA في نسخة أولية نُشرت بعد خمسة أيام. ولكن بعد أسبوع واحد من ذلك وافقت الإدارة FDA على الدواء بعد أن راجعت البيانات فقط من دراسة المعاهد NIH وتجربتين برعاية شركة غلياد. فقد تجاهلت الإدارة FDA بياناتِ التجربةِ سوليداريتي وكذلك النتائجَ في الصين.
وقد أثار ذلك غضب فريق التجربة سوليداريتي. وتقول كيني: “أنشودة المانترا التي طالما سمعتها على أنها مزحة عن الإدارة FDA تقول” بالله نثق، لكن على كل شخص آخر تقديم البيانات….لذا انظروا إلى جميع البيانات”.
وفي رسالة مفتوحة نُشرت في يوم موافقة الإدارة FDA على الدواء ريمديسفير جادل ميرداد بارسي Merdad Parsey، كبير المسؤولين الطبيين في شركة غيلياد، في أن التجربة سوليداريتي: “لا تلغي نتائج الدراسة الأخرى – لا سيما من تجربة مصممة وفقًا للمعايير العلمية الأكثر صرامة”، مثل دراسة المعاهد NIH. كما أشارت الشركة إلى أن نتائج التجربة سوليداريتي لم تخضع لمراجعة الأقران وأخبرت مجلة ساينس بأن المنظمة WHO لم تقدم بعد إلى شركة غيلياد “مجموعات البيانات الأساسية أو خطة التحليل الإحصائي” من التجربة سوليداريتي.
وتقول المنظمة WHO إن شركة غيلياد كانت تعرف خطة التحليل قبل الانضمام إلى التجربة وستتلقى مجموعة البيانات الكاملة بمجرد اكتمال الدراسة، وأن الإدارة FDA تراجع تقليديًا جميع البيانات المتاحة، بما في ذلك النتائج غير المنشورة. ويقول كليفورد لين Clifford Lane، من المعهد الوطني للحساسية والأمراض المعدية National Institute of Allergy and Infectious Diseases، والذي ساعد على تنفيذ دراسة المعاهد NIH، إن الاختلاف الرئيس بين دراسة المعاهد NIH وبين التجربة سوليداريتي هو “درجة التفصيل” في تحليلات المجموعات الفرعية التي ربما تكون قد استفادت من الدواء. ويقول لين: “أعتقد أن بيانات التجربة سوليداريتي جيدة…إنها دراسة كبيرة جدًا ولها نتيجة مهمة جدًا”.
أما ريتشارد بيتو Richard Peto، الاختصاصي بعلم الإحصاء وعالم الأوبئة من جامعة أكسفورد University of Oxford، والذي ساعد على وضع تصميم التجربة سوليداريتي وتحليل البيانات؛ فيؤكد على أن تجربة المنظمة WHO لا يمكن أن تثبت أن ريمديسيفير لا يفيد في العلاج من كوفيد-19. “لقد ناورت شركة غيلياد والإدارة FDA نوعًا ما في موقف يُطلب إلينا فيه محاولة إثبات أن ريمديسفير غير مفيد بدلاً من التساؤل بالطريقة المعتادة، وهي : ” هل يمكن للمصنعين إثبات أنه مفيد نوعا ما؟”
لا يزال من الممكن أن يساعد ريمديسفير الأشخاص في المراحل المبكرة من المرض، كما يقول مارتن لاندراي Martin Landray من أكسفورد، والذي شارك في إدارة أكبر دراسة في العالم لمختلف علاجات كوفيد-19. ولكنه “بالتأكيد غير مفيد في المرضى ذوي الحالة الشديدة حيث ستكون الفائدة الأكبر لدواء يقدم لهم العلاج”. وعلاج المرضى في وقت مبكر له ثمن. ويقول: “لن تنقذ العديد من الأرواح، وسيتعين عليك علاج الكثير من المرضى…وسيكلف ذلك ثروة”.
وفي الوقت نفسه لم تستبعد التجارب إمكانية حدوث آثار جانبية ضارة. ففي أواخر أغسطس لاحظت المنظمة WHO عددًا كبيرًا غير متناسب من التقارير عن مشكلات في الكبد والكلى لدى المرضى الذين يتناولون ريمديسفير. وفي أكتوبر قالت وكالة الأدوية الأوروبية European Medicines Agency (اختصارا: الوكالة EMA) إن لجنة السلامة التابعة لها بدأت بتقييم تقارير عن إصابات حادة في الكلى لدى بعض المرضى الذين يتناولون الدواء.
وبالنسبة إلى العديد من العلماء، تؤكد هذه التعقيدات أن الإدارة FDA كان يجب أن تستشير اللجنة AMDAC؛ فريق الخبراء الخارجيين التابع لها، لإجراء نقاش مستفيض. وتقول ليندسي بادن Lindsey Baden، رئيسة اللجنة AMDAC وهي اختصاصية بعلم الأمراض المعدية من مستشفى بريغهام والنساء Brigham and Women’s Hospital، إنه مثل تلك الاستشارة كان من الممكن أن “ترتقي بالمناقشة…هيدروكسي كلوروكين، بلازما النقاهة، ريمديسيفير – هذه قرارات معقدة بالنظر إلى الطبيعة غير المكتملة للبيانات. وتقول بادن التي اجتمعت مجموعتها آخر مرة في أكتوبر 2019 … إن إلحاح الحاجة إلى الاستخدام الإكلينيكي يعطي أسبابًا إضافية لإجراء مناقشة مفتوحة.
أوروبا في الظلام
في يوليو منحت الوكالة EMA، النظير الأوروبي للإدارة FDA، “موافقة مشروطة” إلى ريمديسفير – على غرار الإذن EUA – لكنها لم تمنح موافقتها الكاملة بعد. ومع ذلك، فقد تفاوض الاتحاد EU على “اتفاقية مشتريات مشتركة” مع شركة غيلياد، ووقع عليها في 8 أكتوبر، والتي تؤمن ما يصل إلى 500 ألف دورة علاجية مقابل 1.2 بليون دولار. وأكد متحدث باسم المفوضية الأوروبية European Commission لمجلة ساينس أنه لم يتلقوا بلاغا بفشل الدواء في التجربة سوليداريتي حتى اليوم التالي: “لم يكن هناك أي نقاش مع المنظمة WHO حول الدراسة الجارية قبل توقيع العقد”.
وعندما سأل مجلة ساينس شركة غيلياد عن سبب عدم إفصاحها عن بيانات التجربة سوليداريتي أثناء المفاوضات، قالت الشركة إن مسودة المخطوطة التي تلقتها من المنظمة WHO في أواخر سبتمبر “منقحة بشدة”. وتقول المنظمة WHO إن المعلومات الوحيدة التي حجبت كانت النتائج المتعلقة بالأدوية الأخرى المستخدمة في التجربة بسبب اتفاقيات السرية.
ويقول المتحدث باسم المفوضية إنه على الرغم من أن الاتفاقية مع شركة غيلياد تفرض على أعضاء الاتحاد EU سعرًا يبلغ نحو 2400 دولارٍ لدورة كاملة من دواء ريمديسيفير، فإنها لا تلزم أي دولة بشراء الدواء. ولكن يانيس ناتسيس Yannis Natsis ، من تحالف الصحة العامة الأوروبي European Public Health Alliance غير الربحي، يقول إنه بالنظر إلى نتائج التجربة سوليداريتي، ينبغي على الاتحاد EU “على الأقل إعادة التفاوض بشأن حجم الجرعات والسعر”. وبالنسبة إلى كيني، فإن هذا الاستثمار في دواء قد يساعد عددًا قليلاً من المرضى هو هدر “هائل…يمكنك دائمًا أن تقول،” حسنًا، الآن، إذا قسمت السكان وإذا أخذت فقط أولئك الذين لديهم عيون زرقاء وساق خشبية، فربما يكون هذا فعالًا جدا”، كما تقول. وفي 28 أكتوبر أبلغت شركة غيلياد المستثمرين أن ريمديسفير قد جنت 873 مليون دولار حتى الآن خلال عام 2020. وقال أوداي: “نحن فخورون بأن نكون في المقدمة مع مضاد فيروسات قوي جدًا”.
©2020, American Association for the Advancement of Science. All rights reserved