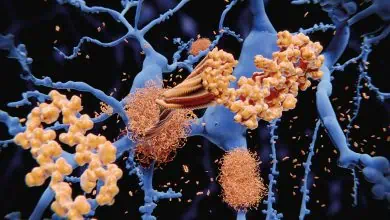
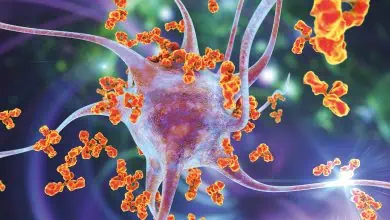
ڤيروسات توقف نموّ الأورام السرطانية(*)
إن تقنية جديدة تدعى المداواة الڤيروسية تسخّر الڤيروسات،
وهي المهلكة للجنس البشري، كي توقف بلاءً آخر هو السرطان
<M.D.نتلبك> ـ <D.كورييل>
الڤيروسات هي من أشدّ الكائنات غدرًا في الطبيعة، وهي تنتقل بسرعة؛ إذ نظرًا إلى تزوّدها بمادة جينية (وراثيّة) ملزوزة بإحكام داخل محفظة بلّوريّة من الپروتين فهي تلتصق بالخلايا، وتغرز فيها جيناتها، وتضمّ إليها آليّة الخلايا في نسخ الجينات gene-copying وصنع الپروتينات، وتستخدمها في صنع بلايين من نسخها ذاتها. وما إن تتشكل هذه الڤيروسات الجديدة حتى تنتقل إلى سطح الخلية وتدخل إلى فقاعات الغشاء الخلوي المتناهية الصغر وتبتعد ببطء(1)؛ أو عوضًا عن ذلك، تستمرّ في التكاثر إلى الحدّ الذي تنفجر فيه الخليّة في نهاية الأمر. ومهما يكن، فهي تُعدي (تخمج) infect خلايا أخرى وتخرّبها؛ وينجم عن ذلك أمراض من الزّكام وحتى الإيدز.
وتسبب الڤيروسات المختلفة أمراضًا متنوعة؛ ويعود ذلك جزئيًا إلى أن كل ڤيروس يدخل خليةً ما بوساطة تعلُّقه في البدء بمستقبل مصاص شبيه بالكأس واقع على سطح الخلية. فخلايا الكبد مثلاً، تعرض نوعًا من المستقبلات تستعمله عائلة واحدة من الڤيروسات؛ في حين تعرض الخلايا العصبية مستقبلاتٍ أخرى تستخدمها عائلة ڤيروسية مغايرة. ولذا فإن كل نمط من الڤيروسات يُعدي (يخمج) ضربًا محددًا من الخلايا. ومنذ سنين مازالت هذه الخاصة الانتقائية تثير حفيظة باحثي السرطان؛ إذ لو كان بوسعهم أن يوجهوا المداواة السرطانية إلى خلايا الأورام فحسب، وأن يتجنبوا في الوقت نفسه تدمير الخلايا السليمة، لأمكنهم التخلّص من كثير من الآثار الجانبيّة الضارة التي تكتنف معالجة السرطان.
إن بعض الباحثين، ونحن منهم، يقومون حاليًا بهندسة جينية لمجموعة من الڤيروسات التي تعمل كقذائفِ بحثٍ وتدمير تُعدي (تخمج) وتقتل خلايا السرطان على نحو انتقائي تاركة الخلايا السليمة دون مساسٍ بها. وقد أظهرت هذه الاستراتيجية الجديدة، التي تدعى المداواة الڤيروسية virotherapy، أنها واعدة في الاختبارات التي أجريت على الحيوانات. أما التجارب السريرية التي تضمّ مرضى من البشر، فمازالت مستمرة. ويُجري الباحثون الآن تقييمًا للمداواة الڤيروسية وحدها وكوسيلة جديدة لتطبيق المداواة الكيميائية المعهودة وإيصالها إلى خلايا الأورام فقط. كما أنهم يعملون على تطوير طرائق لوسْم label الڤيروسات بمياسم مشعّة radioactive tags أو متألّقة fluoroscentلاقتفاء أثر حركة العوامل الڤيروسية لدى المرضى.
نظرة إجمالية/ ڤيروسات مضادة للسرطان(**)
| ▪ إن المداواة الڤيروسية هي استراتيجية جديدة لمعالجة السرطان عن طريق عدوى (خمج) الخلايا الورمية انتقائيًا وقتلها. ويختبر الباحثون الآن مقاربات متعددة لتستهدف الڤيروسات ـ وعلى الأخص الڤيروسات الغدية ـ خلايا السرطان، من دون أي مساس بالخلايا السوية.
▪ يمكن للڤيروسات المستخدمة في المداواة الڤيروسية أن تقتل خلايا الورم عن طريق تشقيقها أو إيصال جينات تجعل تلك الخلايا أكثر تقبّلاً للمعالجات الكيميائية المعهودة. ▪ من الممكن كذلك وَسْمُ الأنماط الڤيروسية نفسها المستعملة في المداواة الڤيروسية بمياسم متألقة أو مشعّة. وحالما تصل إلى الجسم فإنها تتوجه مباشرة إلى خلايا السرطان. وقد يغدو بوسع العلماء في المستقبل استعمال طريقة التصوير هذه لكشف وجود أورام سرطانية صغيرة جدًا. |
أڤيروسات للإنقاذ؟(***)
يعود أحد أوائل التلميحات إلى احتمال كون الڤيروسات مفيدة في مقاومة السرطان إلى عام 1912، حينما لاحظ طبيب نساء إيطالي تراجع سرطان عنق الرحم عند امرأةٍ أُعطيت لقاحًا مضادًا للكَلَب مصنوعًا من شكلٍ حيّ مُضْعَف من ڤيروس الكَلَب. وحَقَن الأطباء الڤيروسات عمدًا في بعض مرضى السرطان للمرة الأولى في أواخر عقد الأربعينات. ولكن لم تظهر فائدته إلاّ في حالات قليلة فحسب. وبعد عشرين سنة، وجد العلماء أن الڤيروس الذي يسبب اضطرابًا بيطريا (هو داء نيوكاسل newcastle disease)، يُظهر تفضيلاً لإصابة خلايا الأورام بالعدوى. فشرعوا يجرّبون تعزيز ذاك الميل عن طريق إنماء تلك الڤيروسات، وعلى امتداد أجيال، في خلايا سرطانية بشرية ضمن أطباق مستنبتات في المختبر. وقد عارض النقاد ذاك الادّعاء، وقالوا إن تلك الڤيروسات لا تمارس إلاّ تأثيرًا غير مباشر في السرطان وذلك بتنشيطها العام للجهاز المناعي لدى المصاب بالسرطان؛ مما يزيد أرجحية هذا الجهاز لكشف الخلايا السرطانية وقتلها، ومع ذلك، استمرّ ظهور تقارير طبية تربط بين العدوى (الخمج) الڤيروسية وهدأة السرطان. وفي أوائل عقدي السبعينات والثمانينات وصف فريقان من الأطباء مرضى تضاءلت عندهم اللمفومات (الأورام اللمفية) بعد إصابتهم بالحصبة.

ڤيروسات غدّية تنفجر من خلية سرطانية أصابتها بالعدوى (خمجتها) لتقتلها. ويمكن لهذه الڤيروسات الانتشار للقضاء على خلايا سرطانية أخرى. |
لقد بدأ ظهور المفهوم الحديث للمداواة الڤيروسية في أواخر التسعينات من القرن الماضي، عندما قام باحثون على رأسهم <F.ماك كورميك> [من شركة Onyxللصيدلانيات في ريتشموند بولاية كاليفورنيا]، و<R.D .هندرسون> [من شركةCalydon في سنيفيل بولاية كاليفورنيا أيضًا]، كل منهما على انفراد، بنشر تقارير تبين أنهم استطاعوا توجيه المداواة الڤيروسية لتستهدف خلايا السرطان التي جرى تطعيم الفئران بها، وبذا قضوا على الأورام البشرية. (لقد توقفت الشركة Onyx عن تطوير ڤيروسات علاجية، كما آلت ملكية الشركةCalydon إلى شركة Cell genesys بكاليفورنيا). وقد وظَّف كلا الفريقين الڤيروسات الغُدِّية adenoviruses، التي تسبب الزكام وجرت دراستها على نحو معمَّق لاستعمالها في المداواة الڤيروسية. [وتشمل الڤيروسات الأخرى الخاضعة للدراسة ڤيروس الحلأ البسيط herpes simplex والڤيروس الصغير parvovirusوڤيروس الوَقْس (جدري البقر) والڤيروس الريوي (الڤيروس التنفسي المعوي)reovirus]. وإلى حد ما، يفضل الباحثون استخدام الڤيروس الغُدِّي لأنهم يعرفون بيولوجيته على نحو جيد بعد سنوات من معالجة حالات الزكام التي يسببها، واستعماله في أبحاث البيولوجيا الجُزَيْئية والمداواة الجينية. ويتألف هذا الڤيروس من محفظة (قُفَيْصة) capsid پروتينية ذات 20 وجهًا، وهي مليئة بالدناDNA ومزودة بـ 12 «ذراعًا» پروتينية. ولقد تطورت هذه البروزات(2) خلال آلاف السنين كي تتثبت على مستقبلٍ خلوي وظيفتهُ الطبيعية مساعدة الخلايا على الالتصاق بعضها ببعض. وتتميز الڤيروسات الغُدِّية عن أنماط الڤيروسات الأخرى التي يُعتمد عليها عادة في المداواة الجينية لمعالجة اضطرابات وراثية(3). وبحكم المأثور، تَستخدِم المداواة الجينية الڤيروسات القهقرية retrovirusesبغية إدخال نسخةٍ فاعلةٍ من جينة ما إلى جسم مريضٍ توقفت عنده تلك الجينة عن القيام بعملها على نحو سليم. ولكن الڤيروسات الغُدّية، خلافًا للڤيروسات القهقرية، لا تدمج دناها في جينات الخلايا التي تعديها (تخمجها). فالجينات التي تحملها إلى داخل خليةٍ ما تعمل عادة زمنًا قصيرًا لا تلبث أن تتعطّل بعده. وقد استقصى العلماء الڤيروسات الغُدِّية بشكل شامل في طرائق المداواة الجينية لعلاج السرطان، حيث تكون الڤيروسات مسلَّحة بجيناتٍ يمكنها، مثلاً، أن تجعل خلايا السرطان أكثر من الخلايا السوية تقبُّلاً للمداواة الكيميائية. وبدت الاختبارات التي شملت الڤيروسات الغدّية سليمة بصفة عامة. غير أن ما يؤسف له أن أحد المتطوعين قضى نحبه عام 1999 بعد تسريب infusionڤيروسات غديّة كجزء من تجربة سريرية لاختبار مداواة جينية محتملة لمعالجة اضطراب جيني في الكبد [انظر الإطار في الصفحة 40].
استهداف الملانوم (الورم الملاني)(****)
إن سرطان الجلد الملاني melanoma هو أحد أهم السرطانات المميتة ما لم يكتشف مبكّرًا. وهو ينشأ عن النمو والانتشار العشوائيين للخلايا المتصبغة في الجلد، وتدعى الخلايا الورمية. ويستخدم العلماء الطريقة الجديدة القائمة على المداواة الڤيروسية وذلك لقتل الخلايا الملانية بالذات من دون أن تُمس الخلايا السليمة. وتقتضي إحدى تقنيات دراسة الورم الملاني دمج الخلايا الملانية [نقاط غامقة في المخطط الميكروي في اليمين أدناه] في خلايا الجلد (المسمّاة الخلايا الكراتينية) والكلاجين لعمل جلد اصطناعي يحمل سرطانا يمكن إنماؤه في أطباق الزرع في المختبر. وتوصَّل أحدنا [نتّلبك] وزملاؤه إلى إيجاد ڤيروس غدّي يمكنه التكاثر بشكل نوعيّ في خلايا الورم الملاني. وتبدو في المخططين الميكرويين، في الوسط وفي اليسار أدناه، الخلايا الكراتينية السليمة بلون أحمر؛ فيما تظهر الخلايا التي أصابها الڤيروس بالعدوى بلون أخضر. وقد عُمل المخطط الميكروي في الوسط باستخدام الڤيروسات التي لم تكن تستهدف حصرًا الأورام الملانية. وكان باستطاعة هذه الڤيروسات أن تنمو في الخلايا السليمة، وتجعلها تبدو صفراء اللون. وعلى النقيض، لم يتنسّخ الڤيروس المستهدف [في اليسار أدناه] في الخلايا السليمة، ولذا لا تبدو أي من الخلايا بلون أصفر.
|
ويمضي المختصون بالمعالجة الجينية في العمل على تهيئة ڤيروسات غُدِّية ونواقل ڤيروسية أخرى، أو نظم إيصال جينات، وذلك لتحسين درجة سلامتها والحد من إمكان وقوع المأساة مرة ثانية. وربما كان أشدَّ ضرورة للباحثين الذين يستقصون المداواة الڤيروسية ـ كمثلنا ـ التوصل إلى تطوير نواقل أكثر سلامة وأقوى استهدافًا؛ لأن المداواة الڤيروسية بالتعريف تبتغي قتل الخلايا التي تعديها الڤيروسات، وليس مجرد غرز جينة علاجية ضمنها؛ كما أن من الخطر قتل الخلايا غير المستهدفة.
وتحمل الڤيروسات الغُدِّية معها خصائص ربّما تجعلها أكثر خطورة أو أكثر سلامة، تبعًا للظروف. ويمكن القول: إن كل فرد تقريبًا قد سبق له وتعرَّض للڤيروسات الغدّية. ولهذا يحمل معظمنا أضدادًا يصنعها الجهاز المناعي ويستهدف بها تخريب الڤيروسات الحية. لذا، فقد يسبب حقن جرعات من الڤيروسات الغدّية لمداواة السرطان أعراضًا وخيمة شبيهة بأعراض الإنفلونزا (النزلة الوافدة) فيما إذا تعرَّفها البدن كأجسام غريبة، فيحرِّض استجابة مناعية للقضاء عليها. بيد أن إزالة الڤيروسات ستقضي أيضًا على فاعلية المداواة. وفي الوقت ذاته، إن تعرُّف الجهاز المناعي تلك الڤيروسات يضمن عدم تكاثرها على نحو عشوائي. ويصمّم الباحثون الآن طرائق علاجية متنوعة لإيصال فاعلية المداواة الڤيروسية إلى حدها الأقصى، وجعل فرص حدوث تأثيرات جانبية في حدها الأدنى. وتتضمن هذه الاستراتيجيات إعطاء العقاقير الكابتة للمناعة مع المداواة الڤيروسية، وتحوير الڤيروسات الغدية على نحو يحول دون ظهور ردّ فعلٍ من الجهاز المناعي.
التوجّه مباشرة إلى الهدف(*****)
يعمل اختصاصيّو المداواة الڤيروسية على استنباط استراتيجيتيْن أساسيتيْن للتأكّد من أن قذائفهم تصيب أهدافها بدقة من دون إحداث تخريب جانبي. ففي المقاربة الأولى التي تدعى الاستهداف التنبيغي(4)transductionaltargeting ، يحاول الباحثون تكييف الڤيروسات كي تفضل عدوى أو تنبيغ الخلايا السرطانية. وتشمل الطريقة الثانية، المسمّاة الاستهداف الانتساخيtranscriptional targeting، تحوير الڤيروسات بشكل تصبح فيه جيناتها نشيطة أو منتسخة في الأورام فقط [انظر الإطار في الصفحتين 38 و39].
والاستهداف التنبيغي ضروري جدًا لأن الڤيروسات الغدية، لسوء الطالع، ترتبط بأنواع النسج السوية في الجسم البشري بفاعلية أشدّ من ارتباطها بمعظم الخلايا الورمية. ويمكن قلب هذا النموذج باستخدام جُزيئات مُلْئمةadapter molecules مولَّدة خصيصًا ومصنوعة من أضداد تُطْبق على أذرع الڤيروس وتلتحم بها بإحكام. وبالإمكان جعل الڤيروسات الغدّية عاجزة عن إصابة أي خلايا بالعدوى سوى الخلايا السرطانية، وذلك بوساطة ربط أضدادٍ مختارة بدقة ـ أو جزيئات أخرى ترتبط انتقائيًا ـ بپروتين معيّن موجود على خلايا الورم. وما إن يتثبت الڤيروس الحامل للضد على خلية مستهدَفة حتى تحيطه الخلية المنكوبة بكيسها الغشائي وتسحبه إلى الداخل. وحينما يتلاشى الكيس، تنتقل المحفظة الڤيروسية (القٌفَيْصة) إلى مَسَمّ pore في نواة الخلية، وتحقن دناها الخاص هناك. وسرعان ما يقوم الدنا الڤيروسي بتوجيه الخلية إلى صنع نسخ من هذا الدنا، واصطناع پروتينات ڤيروسية، ومن ثم ربط الاثنين لتوليد بلايين الڤيروسات الغدّية الجديدة. وحينما تحقق الخلية طاقتها القصوى، ينشِّطُ الڤيروس «جينة الموت» ويحضّ الخلية على الانفجار، وبذا تنطلق الڤيروسات الجديدة وتنتشر وتصل إلى خلايا أخرى.
ومن الممكن أيضًا أن تُجرى هندسة الڤيروسات بشكل مباشر أكثر. وفي هذا الشأن، صمَّم فريق كورييل [من مركز المداواة الجينية في جامعة ألاباما] ڤيروسات غدّية ترتبط بپروتينات خلوية تدعى الإنتگرينات integrins. وهذه الجزيئات تساعد الخلايا على الالتصاق بشبكة النسيج الضام connective tissueالتي تسمى المَطْرِق خارج الخلوي extracellular matrix، وهو الذي ينظّم الخلايا فيجعلها نسجًا متلاحمة. ومع أن الإنتگرينات تصنعها الخلايا السليمة أيضًا، فإن الخلايا السرطانية تنتجها بوفرة حينما تصبح نقيلية metastatic، وتبدأ بالضغط خلال طبقات النسج والانتقال إلى أنحاء الجسم. وقد حصل فريق البحث في جامعة ألاباما على نتائج مشجعة باستخدامه الڤيروسات المهندَسة جينيا في الفئران الحاملة لسرطان مبيضي بشري. لقد اتجهت الڤيروسات المهندَسة إلى خلايا الورم البيضي فقتلتها وخلّصت الحيوانات المعالَجة من الداء.
ويستفيد الاستهداف الانتساخي بوجه عام من المفاتيح الجينية المعززات (المُحضِّضات) promoters التي تملي التواتر الذي تؤدي به جينة ما وظيفتها (يولّد الپروتين الذي يكوِّده encodes) في نمط معين من الخلايا. ومع أن كل خلية في البدن تحتوي موسوعة المعلومات الجينية ذاتها، فبعض الخلايا تستخدم فصولاً مختلفة من هذه الموسوعة على نحو أكثر تكرارًا من غيرها كي تنجز مهماتها التي اختصت بها. وعلى سبيل المثال، يجب على خلايا الجلد، التي تدعى الخلايا الملانية melanocytes، أن تصنع من صِباغ الملانين أكثر مما تصنعه خلايا الكبد التي تقلّ حاجتها إلى هذا الپروتين. وحسب ذلك، يبدأ معزز (مُحضِّض) الإنزيم الأساسي بصنع الملانين في الخلايا الملانية، ولكنه يتوقف عن العمل عمومًا في معظم نسج الجسم الأخرى. ففي الملانوم الذي هو سرطان جلدي مميت تؤدي الجينة المكوِّدة لهذا الإنزيم وظيفتها كاملة، وتجعل الأورام تبدو سوداء اللون. وقد أجرى فريقنا وباحثون آخرون، هندسةً جينية لڤيروسات غدية لها معزز للإنزيم المجاور للجينات اللازمة لقابلية الڤيروسات على التضاعف. ومع أن هذه الڤيروسات قد تُعدي الخلايا السوية، كخلايا الكبد، فهي لا تستطيع التكاثر إلاّ داخل الخلايا الملانية التي تحوي التوليفةcombination الخاصة من الپروتينات الضرورية لتشغيل مفتاح المعزز (المحضِّض).
ويهيئ الباحثون الآن ڤيروسات غدية ذات معززات مختلفة تحصر نشاطها ضمن أعضاءٍ أو نسجٍ خاصة. ففي سرطانات الكبد مثلاً، يستعيد معزِّز الجينة -فيتوپروتين – fetoprotein نشاطه الذي يتوقف عن العمل بصورة طبيعية بعد التطور الجنيني fetal. فالڤيروسات الغدية التي تحوي ذاك المعزز تحمل الأمل في القضاء على أورام الكبد. وقد اختبر علماء، في مقدمتهم <W.J.سيمونز> [من جامعة جونز هوپكنز]، تلك المقاربة في رجال عاودهم سرطان الپروستاته (الموثة) بعد المعالجة الشعاعية. واستخدم أولئك الباحثون ڤيروسات غديّة سبق أن هندستْها الشركة Cell Genesys لتحوي معزز المستضد antigen النوعي للپروستاته، وهو پروتين تصنعه أورام الپروستاته بوفرة. ولقد طبقوا المداواة الڤيروسية على 20 رجلاً تناولوا جرعات متفاوتة من الڤيروسات الغدية. وذكر سيمونز وزملاؤه عام 2001 أنه لم يتعرض أحد من أولئك المرضى لتأثيرات جانبية خطرة، وأن أورام الرجال الخمسة، الذين حصلوا على أعلى المقادير من المداواة الڤيروسية، تضاءلت بنسبة 50 في المئة على أقل تقدير.
استراتيجيات أخرى(******)
وقد يتوصّل أصحاب المداواة الڤيروسية إلى دمج استراتيجيتي الاستهداف التنبيغي والاستهداف الانتساخي لضمان قيام الڤيروسات بقتل الخلايا الورمية فقط من دون المساس بالخلايا السليمة، فمثلاً، تستطيع الڤيروسات الغدّية التي تمَّت هندستها جينيًا كي تحتوي معزز الإنزيم الذي يصنع الملانين أن تتنسَّخ replicate في الخلايا الملانية السوية؛ ولذا يمكنها وحدها أن تسبّب بقعًا من زوال الصباغ. ومازال بوسع الڤيروسات الغدّية المصمّمة للارتباط بمستقبلات على سطوح الخلايا الورمية أن تغزو نسبة ضئيلة من الخلايا السليمة. ومن المتوقع أن تُضعِف أرجحية إيذاء الخلايا السليمة في الڤيروسات التي تم تعديلها وتزويدها بآليات تعويضٍ متعددة تُُجنّبها تخريب تلك الخلايا. ولكن لا تتوافر الآن نتائج تبرهن على أن دمج الطرائق يجعل الڤيروسات أشد استهدافًا لخلايا الأورام.
مهاجمة الخلايا السرطانية بالڤيروسات(*******)
| يستقصي الباحثون استراتيجيتين أساسيتين للمداواة الڤيروسية، وهي تقنية استخدام الڤيروسات المتكاثرة للقضاء على الأورام السرطانية. ففي الطريقة الأولى التي تدعى الاستهداف التنبيغي [في الأسفل] يحاول العلماء هندسة الڤيروسات كالڤيروس الغدّي ـ الذي يسبب عادة العداوى (الأخماج) التنفسية ـ ليُعدي على نحو انتقائي الخلايا التي صارت سرطانية، وليدمّرها وحدها. وهم يعلقون جُزَيْئات مُلْئمة adapter molecules على پروتينات غلاف الڤيروسات الخارجي، أو يحورون مباشرة هذه الپروتينات في محاولة لمنع الڤيروسات من الدخول إلى الخلايا السوية وتحفيزها بدلاً من ذلك على التوجّه مباشرة إلى الخلايا الورمية. وتقتضي المقاربة الثانية [في الأسفل] وضع شُدفة صغيرة جدًا من الدناDNA تدعى المُعزز (المُحَضِّض) promoter النوعي للورم بجانب إحدى الجينات الضرورية للڤيروس الغدي. ويعمل هذا المعزز كمفتاح «تشغيل» يسمح للجينة بأداء وظيفتها في الخلايا السرطانية فقط. وبإمكان الڤيروسات التي تمَّتْ هندستها جينيًا أن تدخل الخلايا السوية، ولكنها تعجز عن أن تتكاثر فيها وتقضي عليها. ولكن ما إن تدخل هذه الڤيروسات إلى الخلايا السرطانية حتى يسمح لها المعزز النوعي للورم بصنع ملايين النسخ عن ذاتها وفي نهاية الأمر تفجير الخلايا السرطانية. وبعدئذ، تنتشر تلك الڤيروسات وتدمّر أورامًا أخرى.
|
| ڤيروس غدّي جرت هندسته جينيًا مع حلقات وصل للمعزز (المحضض) النوعي للورم بالجينة الأساسية للڤيروس
تنفجر الخلية، ويُعدي الڤيروس خلايا سرطانية أخرى ويقتلها تحدث العدوى، ولكن الخلية السوية لا تملك مفتاح تشغيل الجينة السوية، ولهذا لا يستطيع الڤيروس أن يتنسّخ أو أن يقتل الخلية
|
وهناك استراتيجية أخرى لتوجيه المداواة الڤيروسية إلى هدفها، وتستفيد إلى أبعد الحدود من إحدى صفات السرطان وهي قدرة الخلية الورمية على الانقسام مرة بعد أخرى بطريقة لا ضابط لها. وتصنع الخلايا السليمة الپروتينات التي تعمل كمكابح طبيعية تحدّ من الانقسام الخلوي ـ وبالأخص پروتين ورم أرومة الشبكية (Rb) والپروتين 53. ولكن حينما تغدو الخلايا سرطانية، فإن الجينات التي تكوِّد أحد هذين الپروتينين إمّا أن تتعرَّض لطفرة أو يتعطل نشاطها. وتتدخل بعض الڤيروسات، بما فيها الڤيروسات الغدية، في الآليات الكابحة في الخلية السوّية بوساطة صنعها پروتينات تلتصق بپروتين ورم أرومة الشبكية أو الپروتين 53 وتعطلهما. وهي تؤديّ هذا العمل لأنه يتعذر عليها أن تتنسخ إلاّ في الخلايا التي تتهيأ للانقسام.
لكن، أهي طريقة مأمونة؟(********)
| يعتمد العديد من مقاربات المداواة الڤيروسية على استخدام الڤيروسات الغدّية التي سببت الموت في إحدى التجارب السريرية في مداواة جينية قبل أربع سنوات. ففي الشهر9/1999 توفي <J.جلسنگر> الشاب البالغ من العمر 18 عامًا بعد تلقيه داخل كبده تسريبًا infusion لڤيروسات غدية. لقد كان لديه شكل معتدل من مرض كبدي موروث [وهو عوز ناقلة كروبومايل الأورنيتين (OTCD)]، وكان يشارك في تجربة سريرية لاختبار مداواة جينية جديدة تستخدم فيها الڤيروسات الغدية لنقل نسخة مصحَّحة من الجينة التي تكوِّد الناقلة OTCD إلى خلايا كبده. ولسوء الطالع، قضى الشاب نحبه بعد أربعة أيام من تسريب الڤيروسات بسبب متلازمةِ ضائقةٍ تنفسيةٍ حادة مع فشلٍ في أعضاء متعددة بدا ناجمًا عن ردّ فعلٍ مناعي شديد تجاه المقدار الكبير من الڤيروسات الغدية التي تلقاها كجزء من التجربة.
ومع أن موت جلسنگر مثَّل جانبًا من تجربة مداواة جينية، فقد كان لتلك المأساة عواقبها في مجال المعالجة الڤيروسية الجديد. إن المداواة الجينية تستخدم نسخًا معطلة من الڤيروسات كالڤيروس الغدي، لإدخال جينة جديدة إلى الخلايا؛ فيما توظف المداواة الڤيروسية الڤيروسات ذات التنسّخ النشيط [التي قد تحتوي أو لا تحتوي على جينات مضافة] لقتل أنماط خلوية معينة. ولكن يعتمد كل منهما اعتمادًا كبيرًا على الڤيروسات الغديّة. وأظهر تشريح جثة جلسنگر أن الڤيروسات التي هُنْدِستْ جينيًا قد انتشرت ووصلت إلى الطّحال والعقد اللمفية ونقي العظم. وبيَّن فحص سجلاّته احتمال وجود ضعف شديد في وظيفته الكبدية يحول دون أهليته للتطوع في التجربة. ورأى عدد من الباحثين أنه ربما أظهر ردَّ الفعل المناعي الهائل ذاك لأنه سبق تعرضه لعدوى بڤيروس غدّي حدث بشكل طبيعي. ومنذ وفاة جلسنگر، ركَّز كلٌّ من المعالجين بالجينات والمعالجين بالڤيروسات جهودهم على تشذيب الڤيروسات الغدّية لجعلها أكثر أمانًا. ولكن لايزال الباحثون غير متأكدين من سبب ردّ الفعل الهائل الذي بدا عند جلسنگر بعد تسريب الڤيروسات الغدية. وقد أعطيت جرعة مماثلة من تلك الڤيروسات إلى مريض ثانٍ مشارك في التجربة السريرية فتحمَّلها. وهناك عشرات المرضى في أنحاء العالم الذين عولجوا بالڤيروسات الغدّية من دون آثار جانبية خطيرة. ويوصي تقرير المعاهد الوطنية للصحة في الولايات المتحدة الذي نشر عقب موت جلسنگر بوجوب مراقبةٍ عن كثب لجميع المشتركين في التجارب السريرية، من أجل فهم ردود الفعل السميّة، وذلك قبل تسريب الڤيروسات العلاجية وبعده. كما يشترط وجوب تحري المتطوعين جميعًا بحثًا عن أية عوامل مؤهِّبة يمكنها أن تزيد تحسسهم تجاه الڤيروسات.
|
ولقد أنجز عدد من فرق الأبحاث وشركات التقانة الحيوية هندسة ڤيروسات غدّية لا تستطيع صنع محصرات blockers پروتين ورم أرومة الشبكية Rb أو الپروتين 533. إن الخلايا السوية، التي تصنع هذه المحصرات، ستوقف تنسُّخ هذه الڤيروسات عن طريق كبحها الانقسام الخلوي. بيد أن هذه الڤيروسات ستتنسّخ في الخلايا التي تعطَّل فيها پروتين ورم أرومة الشبكية أو الپروتين 53 سلفًا ـ أي خلايا السرطان ـ وتقتلها. ويضع كورييل خططًا لإجراء تجارب سريرية على هذه الطريقة لمعالجة سرطان المبيض.
ويقوم الباحثون أيضًا بتزويد الڤيروسات العلاجية بجينات تجعل الخلايا التي تعديها مستعدة على نحو فريد لتقبّل المداواة الكيميائية. وتقتضي هذه التقنية وصلاً بين الڤيروسات وبين جينات تكوِّد الإنزيمات التي تحول الطلائع غير السّامّة، أو «طلائع الأدوية» إلى معالجات كيميائية مؤذية. وفي مثال ورد ذكره عام 2002، صمَّم <A.ليبر> والعاملون معه [من جامعة واشنطن] ڤيروسات غدّيّة لحمل الجينات المكوِّدة للإنزيمات القادرة على تحويل طلائع الأدوية غير المؤذية إلى مركبات كامبتوثيسين و 5 -فلوروأوراسيل المضادة للسرطان. وأجرى العلماء هندسة جينية للڤيروسات بحيث تستطيع صنع الإنزيمات في الخلايا النشيطة الانقسام فحسب، كالخلايا السرطانية. وحينما حقنوا الڤيروسات وطلائع الأدوية في الفئران التي زُرعت فيها خلايا بشرية من سرطان القولون أو الرحم، وجدوا أن الڤيروسات تكاثرت وانتشرت في الأورام.
شركات مختارة تعمل في مجال المداواة الڤيروسية (*********)
وتُعدُّ هذه الأنماط من المداواة الڤيروسية «الذكية» طليعة المداواة في المستقبل. ولكن ستبرز أمام الأطباء أيضًا ضرورة اقتفاء أثر فعالية المعالجات الڤيروسية في جسم المريض لإجراء أفضل تقييم لمدى نجاح تلك الاستراتيجيات وتشذيبها فيما بعد. ويعمل اختصاصيو المداواة الڤيروسية الآن متضافرين مع أطباء الأشعة لإرساء قواعد تقانات تصويرٍ جديدة تقيس بسهولة مقدار تنسُّخ الڤيروسات وفاعلية المداواة بها.
وتشمل استراتيجيات التصوير غرز جينة تتحكم في إنتاج جُزيء قائفtracer molecule ضمن ڤيروس أو ضمن خلية مصابة بڤيروس. وهذا الجزيء القائف إمّا أن يكون پروتينًا متألّقًا يُلاحَظ مباشرة، أو پروتينًا يرتبط سريعًا بنيكليوتيدات (بنُوَيْداتٍ) مشعَّة radionuclides تُستَخدم في تقنيات التصوير الشعاعي المعياري. وربما استطاع الپروتين المتألّق أن يعمل على أفضل وجه في السرطانات التي يمكن الوصول إليها بوساطة المنظار الداخلي، كسرطان الحنجرة. وباستعمالهم هذا المنظار، نجح الأطباء في رؤية مكان وجود الڤيروسات بدقة ـ ومن ثمّ الخلايا السرطانية ـ معتمدين في ذلك على البحث عن التألّق. ولكن لم تثبت هذه الطريقة نجاعتها حتى الآن إلاّ في الڤيروسات التي لا تقتل الخلايا. ومع ذلك، إنّنا على يقين بأن مثل هذه التقانات التصويرية المعقدة ستمكّن العلماء من استخلاص نتائج مهمة من التجارب السريرية التي ستُجرى في المستقبل على المداواة الڤيروسية.
وفي عام 1995 تنبأ رائد المداواة الجينية <F.W.أندرسون> [من كلية الطب في جامعة ساوث كاليفورنيا] حينما نشر في مجلة ساينتفيك أمريكان أنه «بحلول عام 2000…. ستصبح النسخ الأولى من النواقل القابلة للحقن، التي تستهدف خلايا معينة، متوافرة في التجارب السريرية.» وقد بدأ في الواقع إجراء هذه التجارب وفق الخطة الموضوعة، إضافة إلى تجارب أخرى لم يكن بإمكانه تصورها آنذاك. ونحن نتوقع أن تؤدي الڤيروسات دورًا مهمًا في كونها ڤيروسات علاجية في طب القرن الحادي والعشرين.
المؤلف
Dirk M. Nettelbeck – David T. Curiel
بدآ تعاونهما في مركز المداواة الجينية بجامعة ألاباما في برمنگهام [UAB]، حيث يعمل كورييل مديرًا لقسم المداواة الجينية البشرية. وكورييل، الذي يحمل الدكتوراه في الطب والدكتوراه في العلوم، هو رئيس قسم جين وآن گريفّن لأبحاث سرطان النساء في جامعة ألاباما، كما أنه أستاذ المداواة الجينية في الجامعة الحرة في أمستردام. أما نتِّلبك ـ الذي يرأس الآن فريق بحث يركّز على المعالجة الڤيروسية للملانوم (الورم الملاني) الخبيث في قسم الأمراض الجلدية بجامعة إرلانگن نورمبرگ بألمانيا ـ فكان اختصاصيًا في البيولوجيا الجزيئية وزميل ما بعد الدكتوراه في جمعية الأبحاث الألمانية بجامعة ألاباما بين عامي 2000 و2003. وقد حصل على الدكتوراه في العلوم عامي 2000 من جامعة فيليپس في ماربورگ بألمانيا، وكُرِّم بجائزة تخرُّجٍ من قبل مؤسسة نوڤاريتس للأبحاث العلاجية.
مراجع للاستزادة
Gene Therapy; Designer Promoters for TumourTargetlng.
D. M. Nettelbeck, V. Jerome and R. Muller in Trends in Genetics, Vol. 16, pages 174-181; 2000.
Replicative Adenoviruses for Cancer Therapy. R. Alemany, C. Balagu€ and D. T. Curiel in Nature Biotechnology, Vol. 18, pages 723-727; 2000. Vector Targeting for Therapeutic Gene Delivery. Edited by D. T. Curiel and J. T. Douglas. John Wiley A: Sons, 2002.
Cytolytic Viruses as Potential Anti-Cancer Agents. C.J.A. Ring in Journal of General Virology, Vol. 83, pages 491-502; 2002. Gene therapy clinical trials database of Journal of Gene Medicine:
www.wtley.com/legacy/wileychl/genmed/clinical/ , American Society of Gene Therapy: www.asgt.org
Scientific American, October 2003
(*) TUMOR-BUSTING VIRUSES
(**) Overview/ Anticancer Viruses
(***)Viruses to the Rescue?
(****) Homing In on the Target
(*****) Targeling Melanoma
(******) Other Strategies
(*******) Zapping Cancer Cells with Viruses
(********)But Is It Safe?
(*********) Selected Companies Involved in Virotherapy
( drift away (1
(2)protrusions
(3) inherited disorder
(4) التنبيغ transduction هو انتقال شُدفةِ دنا DNA من حي ميكروي إلى آخر. (التحرير)
(*)
إن تقنية جديدة تدعى المداواة الڤيروسية تسخّر الڤيروسات،
وهي المهلكة للجنس البشري، كي توقف بلاءً آخر هو السرطان
<M.D.نتلبك> ـ <D.كورييل>
الڤيروسات هي من أشدّ الكائنات غدرًا في الطبيعة، وهي تنتقل بسرعة؛ إذ نظرًا إلى تزوّدها بمادة جينية (وراثيّة) ملزوزة بإحكام داخل محفظة بلّوريّة من الپروتين فهي تلتصق بالخلايا، وتغرز فيها جيناتها، وتضمّ إليها آليّة الخلايا في نسخ الجينات gene-copying وصنع الپروتينات، وتستخدمها في صنع بلايين من نسخها ذاتها. وما إن تتشكل هذه الڤيروسات الجديدة حتى تنتقل إلى سطح الخلية وتدخل إلى فقاعات الغشاء الخلوي المتناهية الصغر وتبتعد ببطء(1)؛ أو عوضًا عن ذلك، تستمرّ في التكاثر إلى الحدّ الذي تنفجر فيه الخليّة في نهاية الأمر. ومهما يكن، فهي تُعدي (تخمج) infect خلايا أخرى وتخرّبها؛ وينجم عن ذلك أمراض من الزّكام وحتى الإيدز.
وتسبب الڤيروسات المختلفة أمراضًا متنوعة؛ ويعود ذلك جزئيًا إلى أن كل ڤيروس يدخل خليةً ما بوساطة تعلُّقه في البدء بمستقبل مصاص شبيه بالكأس واقع على سطح الخلية. فخلايا الكبد مثلاً، تعرض نوعًا من المستقبلات تستعمله عائلة واحدة من الڤيروسات؛ في حين تعرض الخلايا العصبية مستقبلاتٍ أخرى تستخدمها عائلة ڤيروسية مغايرة. ولذا فإن كل نمط من الڤيروسات يُعدي (يخمج) ضربًا محددًا من الخلايا. ومنذ سنين مازالت هذه الخاصة الانتقائية تثير حفيظة باحثي السرطان؛ إذ لو كان بوسعهم أن يوجهوا المداواة السرطانية إلى خلايا الأورام فحسب، وأن يتجنبوا في الوقت نفسه تدمير الخلايا السليمة، لأمكنهم التخلّص من كثير من الآثار الجانبيّة الضارة التي تكتنف معالجة السرطان.
إن بعض الباحثين، ونحن منهم، يقومون حاليًا بهندسة جينية لمجموعة من الڤيروسات التي تعمل كقذائفِ بحثٍ وتدمير تُعدي (تخمج) وتقتل خلايا السرطان على نحو انتقائي تاركة الخلايا السليمة دون مساسٍ بها. وقد أظهرت هذه الاستراتيجية الجديدة، التي تدعى المداواة الڤيروسية virotherapy، أنها واعدة في الاختبارات التي أجريت على الحيوانات. أما التجارب السريرية التي تضمّ مرضى من البشر، فمازالت مستمرة. ويُجري الباحثون الآن تقييمًا للمداواة الڤيروسية وحدها وكوسيلة جديدة لتطبيق المداواة الكيميائية المعهودة وإيصالها إلى خلايا الأورام فقط. كما أنهم يعملون على تطوير طرائق لوسْم label الڤيروسات بمياسم مشعّة radioactive tags أو متألّقة fluoroscentلاقتفاء أثر حركة العوامل الڤيروسية لدى المرضى.
نظرة إجمالية/ ڤيروسات مضادة للسرطان(**)
| ▪ إن المداواة الڤيروسية هي استراتيجية جديدة لمعالجة السرطان عن طريق عدوى (خمج) الخلايا الورمية انتقائيًا وقتلها. ويختبر الباحثون الآن مقاربات متعددة لتستهدف الڤيروسات ـ وعلى الأخص الڤيروسات الغدية ـ خلايا السرطان، من دون أي مساس بالخلايا السوية.
▪ يمكن للڤيروسات المستخدمة في المداواة الڤيروسية أن تقتل خلايا الورم عن طريق تشقيقها أو إيصال جينات تجعل تلك الخلايا أكثر تقبّلاً للمعالجات الكيميائية المعهودة. ▪ من الممكن كذلك وَسْمُ الأنماط الڤيروسية نفسها المستعملة في المداواة الڤيروسية بمياسم متألقة أو مشعّة. وحالما تصل إلى الجسم فإنها تتوجه مباشرة إلى خلايا السرطان. وقد يغدو بوسع العلماء في المستقبل استعمال طريقة التصوير هذه لكشف وجود أورام سرطانية صغيرة جدًا. |
أڤيروسات للإنقاذ؟(***)
يعود أحد أوائل التلميحات إلى احتمال كون الڤيروسات مفيدة في مقاومة السرطان إلى عام 1912، حينما لاحظ طبيب نساء إيطالي تراجع سرطان عنق الرحم عند امرأةٍ أُعطيت لقاحًا مضادًا للكَلَب مصنوعًا من شكلٍ حيّ مُضْعَف من ڤيروس الكَلَب. وحَقَن الأطباء الڤيروسات عمدًا في بعض مرضى السرطان للمرة الأولى في أواخر عقد الأربعينات. ولكن لم تظهر فائدته إلاّ في حالات قليلة فحسب. وبعد عشرين سنة، وجد العلماء أن الڤيروس الذي يسبب اضطرابًا بيطريا (هو داء نيوكاسل newcastle disease)، يُظهر تفضيلاً لإصابة خلايا الأورام بالعدوى. فشرعوا يجرّبون تعزيز ذاك الميل عن طريق إنماء تلك الڤيروسات، وعلى امتداد أجيال، في خلايا سرطانية بشرية ضمن أطباق مستنبتات في المختبر. وقد عارض النقاد ذاك الادّعاء، وقالوا إن تلك الڤيروسات لا تمارس إلاّ تأثيرًا غير مباشر في السرطان وذلك بتنشيطها العام للجهاز المناعي لدى المصاب بالسرطان؛ مما يزيد أرجحية هذا الجهاز لكشف الخلايا السرطانية وقتلها، ومع ذلك، استمرّ ظهور تقارير طبية تربط بين العدوى (الخمج) الڤيروسية وهدأة السرطان. وفي أوائل عقدي السبعينات والثمانينات وصف فريقان من الأطباء مرضى تضاءلت عندهم اللمفومات (الأورام اللمفية) بعد إصابتهم بالحصبة.

ڤيروسات غدّية تنفجر من خلية سرطانية أصابتها بالعدوى (خمجتها) لتقتلها. ويمكن لهذه الڤيروسات الانتشار للقضاء على خلايا سرطانية أخرى. |
لقد بدأ ظهور المفهوم الحديث للمداواة الڤيروسية في أواخر التسعينات من القرن الماضي، عندما قام باحثون على رأسهم <F.ماك كورميك> [من شركة Onyxللصيدلانيات في ريتشموند بولاية كاليفورنيا]، و<R.D .هندرسون> [من شركةCalydon في سنيفيل بولاية كاليفورنيا أيضًا]، كل منهما على انفراد، بنشر تقارير تبين أنهم استطاعوا توجيه المداواة الڤيروسية لتستهدف خلايا السرطان التي جرى تطعيم الفئران بها، وبذا قضوا على الأورام البشرية. (لقد توقفت الشركة Onyx عن تطوير ڤيروسات علاجية، كما آلت ملكية الشركةCalydon إلى شركة Cell genesys بكاليفورنيا). وقد وظَّف كلا الفريقين الڤيروسات الغُدِّية adenoviruses، التي تسبب الزكام وجرت دراستها على نحو معمَّق لاستعمالها في المداواة الڤيروسية. [وتشمل الڤيروسات الأخرى الخاضعة للدراسة ڤيروس الحلأ البسيط herpes simplex والڤيروس الصغير parvovirusوڤيروس الوَقْس (جدري البقر) والڤيروس الريوي (الڤيروس التنفسي المعوي)reovirus]. وإلى حد ما، يفضل الباحثون استخدام الڤيروس الغُدِّي لأنهم يعرفون بيولوجيته على نحو جيد بعد سنوات من معالجة حالات الزكام التي يسببها، واستعماله في أبحاث البيولوجيا الجُزَيْئية والمداواة الجينية. ويتألف هذا الڤيروس من محفظة (قُفَيْصة) capsid پروتينية ذات 20 وجهًا، وهي مليئة بالدناDNA ومزودة بـ 12 «ذراعًا» پروتينية. ولقد تطورت هذه البروزات(2) خلال آلاف السنين كي تتثبت على مستقبلٍ خلوي وظيفتهُ الطبيعية مساعدة الخلايا على الالتصاق بعضها ببعض. وتتميز الڤيروسات الغُدِّية عن أنماط الڤيروسات الأخرى التي يُعتمد عليها عادة في المداواة الجينية لمعالجة اضطرابات وراثية(3). وبحكم المأثور، تَستخدِم المداواة الجينية الڤيروسات القهقرية retrovirusesبغية إدخال نسخةٍ فاعلةٍ من جينة ما إلى جسم مريضٍ توقفت عنده تلك الجينة عن القيام بعملها على نحو سليم. ولكن الڤيروسات الغُدّية، خلافًا للڤيروسات القهقرية، لا تدمج دناها في جينات الخلايا التي تعديها (تخمجها). فالجينات التي تحملها إلى داخل خليةٍ ما تعمل عادة زمنًا قصيرًا لا تلبث أن تتعطّل بعده. وقد استقصى العلماء الڤيروسات الغُدِّية بشكل شامل في طرائق المداواة الجينية لعلاج السرطان، حيث تكون الڤيروسات مسلَّحة بجيناتٍ يمكنها، مثلاً، أن تجعل خلايا السرطان أكثر من الخلايا السوية تقبُّلاً للمداواة الكيميائية. وبدت الاختبارات التي شملت الڤيروسات الغدّية سليمة بصفة عامة. غير أن ما يؤسف له أن أحد المتطوعين قضى نحبه عام 1999 بعد تسريب infusionڤيروسات غديّة كجزء من تجربة سريرية لاختبار مداواة جينية محتملة لمعالجة اضطراب جيني في الكبد [انظر الإطار في الصفحة 40].
استهداف الملانوم (الورم الملاني)(****)
إن سرطان الجلد الملاني melanoma هو أحد أهم السرطانات المميتة ما لم يكتشف مبكّرًا. وهو ينشأ عن النمو والانتشار العشوائيين للخلايا المتصبغة في الجلد، وتدعى الخلايا الورمية. ويستخدم العلماء الطريقة الجديدة القائمة على المداواة الڤيروسية وذلك لقتل الخلايا الملانية بالذات من دون أن تُمس الخلايا السليمة. وتقتضي إحدى تقنيات دراسة الورم الملاني دمج الخلايا الملانية [نقاط غامقة في المخطط الميكروي في اليمين أدناه] في خلايا الجلد (المسمّاة الخلايا الكراتينية) والكلاجين لعمل جلد اصطناعي يحمل سرطانا يمكن إنماؤه في أطباق الزرع في المختبر. وتوصَّل أحدنا [نتّلبك] وزملاؤه إلى إيجاد ڤيروس غدّي يمكنه التكاثر بشكل نوعيّ في خلايا الورم الملاني. وتبدو في المخططين الميكرويين، في الوسط وفي اليسار أدناه، الخلايا الكراتينية السليمة بلون أحمر؛ فيما تظهر الخلايا التي أصابها الڤيروس بالعدوى بلون أخضر. وقد عُمل المخطط الميكروي في الوسط باستخدام الڤيروسات التي لم تكن تستهدف حصرًا الأورام الملانية. وكان باستطاعة هذه الڤيروسات أن تنمو في الخلايا السليمة، وتجعلها تبدو صفراء اللون. وعلى النقيض، لم يتنسّخ الڤيروس المستهدف [في اليسار أدناه] في الخلايا السليمة، ولذا لا تبدو أي من الخلايا بلون أصفر.
|
ويمضي المختصون بالمعالجة الجينية في العمل على تهيئة ڤيروسات غُدِّية ونواقل ڤيروسية أخرى، أو نظم إيصال جينات، وذلك لتحسين درجة سلامتها والحد من إمكان وقوع المأساة مرة ثانية. وربما كان أشدَّ ضرورة للباحثين الذين يستقصون المداواة الڤيروسية ـ كمثلنا ـ التوصل إلى تطوير نواقل أكثر سلامة وأقوى استهدافًا؛ لأن المداواة الڤيروسية بالتعريف تبتغي قتل الخلايا التي تعديها الڤيروسات، وليس مجرد غرز جينة علاجية ضمنها؛ كما أن من الخطر قتل الخلايا غير المستهدفة.
وتحمل الڤيروسات الغُدِّية معها خصائص ربّما تجعلها أكثر خطورة أو أكثر سلامة، تبعًا للظروف. ويمكن القول: إن كل فرد تقريبًا قد سبق له وتعرَّض للڤيروسات الغدّية. ولهذا يحمل معظمنا أضدادًا يصنعها الجهاز المناعي ويستهدف بها تخريب الڤيروسات الحية. لذا، فقد يسبب حقن جرعات من الڤيروسات الغدّية لمداواة السرطان أعراضًا وخيمة شبيهة بأعراض الإنفلونزا (النزلة الوافدة) فيما إذا تعرَّفها البدن كأجسام غريبة، فيحرِّض استجابة مناعية للقضاء عليها. بيد أن إزالة الڤيروسات ستقضي أيضًا على فاعلية المداواة. وفي الوقت ذاته، إن تعرُّف الجهاز المناعي تلك الڤيروسات يضمن عدم تكاثرها على نحو عشوائي. ويصمّم الباحثون الآن طرائق علاجية متنوعة لإيصال فاعلية المداواة الڤيروسية إلى حدها الأقصى، وجعل فرص حدوث تأثيرات جانبية في حدها الأدنى. وتتضمن هذه الاستراتيجيات إعطاء العقاقير الكابتة للمناعة مع المداواة الڤيروسية، وتحوير الڤيروسات الغدية على نحو يحول دون ظهور ردّ فعلٍ من الجهاز المناعي.
التوجّه مباشرة إلى الهدف(*****)
يعمل اختصاصيّو المداواة الڤيروسية على استنباط استراتيجيتيْن أساسيتيْن للتأكّد من أن قذائفهم تصيب أهدافها بدقة من دون إحداث تخريب جانبي. ففي المقاربة الأولى التي تدعى الاستهداف التنبيغي(4)transductionaltargeting ، يحاول الباحثون تكييف الڤيروسات كي تفضل عدوى أو تنبيغ الخلايا السرطانية. وتشمل الطريقة الثانية، المسمّاة الاستهداف الانتساخيtranscriptional targeting، تحوير الڤيروسات بشكل تصبح فيه جيناتها نشيطة أو منتسخة في الأورام فقط [انظر الإطار في الصفحتين 38 و39].
والاستهداف التنبيغي ضروري جدًا لأن الڤيروسات الغدية، لسوء الطالع، ترتبط بأنواع النسج السوية في الجسم البشري بفاعلية أشدّ من ارتباطها بمعظم الخلايا الورمية. ويمكن قلب هذا النموذج باستخدام جُزيئات مُلْئمةadapter molecules مولَّدة خصيصًا ومصنوعة من أضداد تُطْبق على أذرع الڤيروس وتلتحم بها بإحكام. وبالإمكان جعل الڤيروسات الغدّية عاجزة عن إصابة أي خلايا بالعدوى سوى الخلايا السرطانية، وذلك بوساطة ربط أضدادٍ مختارة بدقة ـ أو جزيئات أخرى ترتبط انتقائيًا ـ بپروتين معيّن موجود على خلايا الورم. وما إن يتثبت الڤيروس الحامل للضد على خلية مستهدَفة حتى تحيطه الخلية المنكوبة بكيسها الغشائي وتسحبه إلى الداخل. وحينما يتلاشى الكيس، تنتقل المحفظة الڤيروسية (القٌفَيْصة) إلى مَسَمّ pore في نواة الخلية، وتحقن دناها الخاص هناك. وسرعان ما يقوم الدنا الڤيروسي بتوجيه الخلية إلى صنع نسخ من هذا الدنا، واصطناع پروتينات ڤيروسية، ومن ثم ربط الاثنين لتوليد بلايين الڤيروسات الغدّية الجديدة. وحينما تحقق الخلية طاقتها القصوى، ينشِّطُ الڤيروس «جينة الموت» ويحضّ الخلية على الانفجار، وبذا تنطلق الڤيروسات الجديدة وتنتشر وتصل إلى خلايا أخرى.
ومن الممكن أيضًا أن تُجرى هندسة الڤيروسات بشكل مباشر أكثر. وفي هذا الشأن، صمَّم فريق كورييل [من مركز المداواة الجينية في جامعة ألاباما] ڤيروسات غدّية ترتبط بپروتينات خلوية تدعى الإنتگرينات integrins. وهذه الجزيئات تساعد الخلايا على الالتصاق بشبكة النسيج الضام connective tissueالتي تسمى المَطْرِق خارج الخلوي extracellular matrix، وهو الذي ينظّم الخلايا فيجعلها نسجًا متلاحمة. ومع أن الإنتگرينات تصنعها الخلايا السليمة أيضًا، فإن الخلايا السرطانية تنتجها بوفرة حينما تصبح نقيلية metastatic، وتبدأ بالضغط خلال طبقات النسج والانتقال إلى أنحاء الجسم. وقد حصل فريق البحث في جامعة ألاباما على نتائج مشجعة باستخدامه الڤيروسات المهندَسة جينيا في الفئران الحاملة لسرطان مبيضي بشري. لقد اتجهت الڤيروسات المهندَسة إلى خلايا الورم البيضي فقتلتها وخلّصت الحيوانات المعالَجة من الداء.
ويستفيد الاستهداف الانتساخي بوجه عام من المفاتيح الجينية المعززات (المُحضِّضات) promoters التي تملي التواتر الذي تؤدي به جينة ما وظيفتها (يولّد الپروتين الذي يكوِّده encodes) في نمط معين من الخلايا. ومع أن كل خلية في البدن تحتوي موسوعة المعلومات الجينية ذاتها، فبعض الخلايا تستخدم فصولاً مختلفة من هذه الموسوعة على نحو أكثر تكرارًا من غيرها كي تنجز مهماتها التي اختصت بها. وعلى سبيل المثال، يجب على خلايا الجلد، التي تدعى الخلايا الملانية melanocytes، أن تصنع من صِباغ الملانين أكثر مما تصنعه خلايا الكبد التي تقلّ حاجتها إلى هذا الپروتين. وحسب ذلك، يبدأ معزز (مُحضِّض) الإنزيم الأساسي بصنع الملانين في الخلايا الملانية، ولكنه يتوقف عن العمل عمومًا في معظم نسج الجسم الأخرى. ففي الملانوم الذي هو سرطان جلدي مميت تؤدي الجينة المكوِّدة لهذا الإنزيم وظيفتها كاملة، وتجعل الأورام تبدو سوداء اللون. وقد أجرى فريقنا وباحثون آخرون، هندسةً جينية لڤيروسات غدية لها معزز للإنزيم المجاور للجينات اللازمة لقابلية الڤيروسات على التضاعف. ومع أن هذه الڤيروسات قد تُعدي الخلايا السوية، كخلايا الكبد، فهي لا تستطيع التكاثر إلاّ داخل الخلايا الملانية التي تحوي التوليفةcombination الخاصة من الپروتينات الضرورية لتشغيل مفتاح المعزز (المحضِّض).
ويهيئ الباحثون الآن ڤيروسات غدية ذات معززات مختلفة تحصر نشاطها ضمن أعضاءٍ أو نسجٍ خاصة. ففي سرطانات الكبد مثلاً، يستعيد معزِّز الجينة -فيتوپروتين – fetoprotein نشاطه الذي يتوقف عن العمل بصورة طبيعية بعد التطور الجنيني fetal. فالڤيروسات الغدية التي تحوي ذاك المعزز تحمل الأمل في القضاء على أورام الكبد. وقد اختبر علماء، في مقدمتهم <W.J.سيمونز> [من جامعة جونز هوپكنز]، تلك المقاربة في رجال عاودهم سرطان الپروستاته (الموثة) بعد المعالجة الشعاعية. واستخدم أولئك الباحثون ڤيروسات غديّة سبق أن هندستْها الشركة Cell Genesys لتحوي معزز المستضد antigen النوعي للپروستاته، وهو پروتين تصنعه أورام الپروستاته بوفرة. ولقد طبقوا المداواة الڤيروسية على 20 رجلاً تناولوا جرعات متفاوتة من الڤيروسات الغدية. وذكر سيمونز وزملاؤه عام 2001 أنه لم يتعرض أحد من أولئك المرضى لتأثيرات جانبية خطرة، وأن أورام الرجال الخمسة، الذين حصلوا على أعلى المقادير من المداواة الڤيروسية، تضاءلت بنسبة 50 في المئة على أقل تقدير.
استراتيجيات أخرى(******)
وقد يتوصّل أصحاب المداواة الڤيروسية إلى دمج استراتيجيتي الاستهداف التنبيغي والاستهداف الانتساخي لضمان قيام الڤيروسات بقتل الخلايا الورمية فقط من دون المساس بالخلايا السليمة، فمثلاً، تستطيع الڤيروسات الغدّية التي تمَّت هندستها جينيًا كي تحتوي معزز الإنزيم الذي يصنع الملانين أن تتنسَّخ replicate في الخلايا الملانية السوية؛ ولذا يمكنها وحدها أن تسبّب بقعًا من زوال الصباغ. ومازال بوسع الڤيروسات الغدّية المصمّمة للارتباط بمستقبلات على سطوح الخلايا الورمية أن تغزو نسبة ضئيلة من الخلايا السليمة. ومن المتوقع أن تُضعِف أرجحية إيذاء الخلايا السليمة في الڤيروسات التي تم تعديلها وتزويدها بآليات تعويضٍ متعددة تُُجنّبها تخريب تلك الخلايا. ولكن لا تتوافر الآن نتائج تبرهن على أن دمج الطرائق يجعل الڤيروسات أشد استهدافًا لخلايا الأورام.
مهاجمة الخلايا السرطانية بالڤيروسات(*******)
| يستقصي الباحثون استراتيجيتين أساسيتين للمداواة الڤيروسية، وهي تقنية استخدام الڤيروسات المتكاثرة للقضاء على الأورام السرطانية. ففي الطريقة الأولى التي تدعى الاستهداف التنبيغي [في الأسفل] يحاول العلماء هندسة الڤيروسات كالڤيروس الغدّي ـ الذي يسبب عادة العداوى (الأخماج) التنفسية ـ ليُعدي على نحو انتقائي الخلايا التي صارت سرطانية، وليدمّرها وحدها. وهم يعلقون جُزَيْئات مُلْئمة adapter molecules على پروتينات غلاف الڤيروسات الخارجي، أو يحورون مباشرة هذه الپروتينات في محاولة لمنع الڤيروسات من الدخول إلى الخلايا السوية وتحفيزها بدلاً من ذلك على التوجّه مباشرة إلى الخلايا الورمية. وتقتضي المقاربة الثانية [في الأسفل] وضع شُدفة صغيرة جدًا من الدناDNA تدعى المُعزز (المُحَضِّض) promoter النوعي للورم بجانب إحدى الجينات الضرورية للڤيروس الغدي. ويعمل هذا المعزز كمفتاح «تشغيل» يسمح للجينة بأداء وظيفتها في الخلايا السرطانية فقط. وبإمكان الڤيروسات التي تمَّتْ هندستها جينيًا أن تدخل الخلايا السوية، ولكنها تعجز عن أن تتكاثر فيها وتقضي عليها. ولكن ما إن تدخل هذه الڤيروسات إلى الخلايا السرطانية حتى يسمح لها المعزز النوعي للورم بصنع ملايين النسخ عن ذاتها وفي نهاية الأمر تفجير الخلايا السرطانية. وبعدئذ، تنتشر تلك الڤيروسات وتدمّر أورامًا أخرى.
|
| ڤيروس غدّي جرت هندسته جينيًا مع حلقات وصل للمعزز (المحضض) النوعي للورم بالجينة الأساسية للڤيروس
تنفجر الخلية، ويُعدي الڤيروس خلايا سرطانية أخرى ويقتلها تحدث العدوى، ولكن الخلية السوية لا تملك مفتاح تشغيل الجينة السوية، ولهذا لا يستطيع الڤيروس أن يتنسّخ أو أن يقتل الخلية
|
وهناك استراتيجية أخرى لتوجيه المداواة الڤيروسية إلى هدفها، وتستفيد إلى أبعد الحدود من إحدى صفات السرطان وهي قدرة الخلية الورمية على الانقسام مرة بعد أخرى بطريقة لا ضابط لها. وتصنع الخلايا السليمة الپروتينات التي تعمل كمكابح طبيعية تحدّ من الانقسام الخلوي ـ وبالأخص پروتين ورم أرومة الشبكية (Rb) والپروتين 53. ولكن حينما تغدو الخلايا سرطانية، فإن الجينات التي تكوِّد أحد هذين الپروتينين إمّا أن تتعرَّض لطفرة أو يتعطل نشاطها. وتتدخل بعض الڤيروسات، بما فيها الڤيروسات الغدية، في الآليات الكابحة في الخلية السوّية بوساطة صنعها پروتينات تلتصق بپروتين ورم أرومة الشبكية أو الپروتين 53 وتعطلهما. وهي تؤديّ هذا العمل لأنه يتعذر عليها أن تتنسخ إلاّ في الخلايا التي تتهيأ للانقسام.
لكن، أهي طريقة مأمونة؟(********)
| يعتمد العديد من مقاربات المداواة الڤيروسية على استخدام الڤيروسات الغدّية التي سببت الموت في إحدى التجارب السريرية في مداواة جينية قبل أربع سنوات. ففي الشهر9/1999 توفي <J.جلسنگر> الشاب البالغ من العمر 18 عامًا بعد تلقيه داخل كبده تسريبًا infusion لڤيروسات غدية. لقد كان لديه شكل معتدل من مرض كبدي موروث [وهو عوز ناقلة كروبومايل الأورنيتين (OTCD)]، وكان يشارك في تجربة سريرية لاختبار مداواة جينية جديدة تستخدم فيها الڤيروسات الغدية لنقل نسخة مصحَّحة من الجينة التي تكوِّد الناقلة OTCD إلى خلايا كبده. ولسوء الطالع، قضى الشاب نحبه بعد أربعة أيام من تسريب الڤيروسات بسبب متلازمةِ ضائقةٍ تنفسيةٍ حادة مع فشلٍ في أعضاء متعددة بدا ناجمًا عن ردّ فعلٍ مناعي شديد تجاه المقدار الكبير من الڤيروسات الغدية التي تلقاها كجزء من التجربة.
ومع أن موت جلسنگر مثَّل جانبًا من تجربة مداواة جينية، فقد كان لتلك المأساة عواقبها في مجال المعالجة الڤيروسية الجديد. إن المداواة الجينية تستخدم نسخًا معطلة من الڤيروسات كالڤيروس الغدي، لإدخال جينة جديدة إلى الخلايا؛ فيما توظف المداواة الڤيروسية الڤيروسات ذات التنسّخ النشيط [التي قد تحتوي أو لا تحتوي على جينات مضافة] لقتل أنماط خلوية معينة. ولكن يعتمد كل منهما اعتمادًا كبيرًا على الڤيروسات الغديّة. وأظهر تشريح جثة جلسنگر أن الڤيروسات التي هُنْدِستْ جينيًا قد انتشرت ووصلت إلى الطّحال والعقد اللمفية ونقي العظم. وبيَّن فحص سجلاّته احتمال وجود ضعف شديد في وظيفته الكبدية يحول دون أهليته للتطوع في التجربة. ورأى عدد من الباحثين أنه ربما أظهر ردَّ الفعل المناعي الهائل ذاك لأنه سبق تعرضه لعدوى بڤيروس غدّي حدث بشكل طبيعي. ومنذ وفاة جلسنگر، ركَّز كلٌّ من المعالجين بالجينات والمعالجين بالڤيروسات جهودهم على تشذيب الڤيروسات الغدّية لجعلها أكثر أمانًا. ولكن لايزال الباحثون غير متأكدين من سبب ردّ الفعل الهائل الذي بدا عند جلسنگر بعد تسريب الڤيروسات الغدية. وقد أعطيت جرعة مماثلة من تلك الڤيروسات إلى مريض ثانٍ مشارك في التجربة السريرية فتحمَّلها. وهناك عشرات المرضى في أنحاء العالم الذين عولجوا بالڤيروسات الغدّية من دون آثار جانبية خطيرة. ويوصي تقرير المعاهد الوطنية للصحة في الولايات المتحدة الذي نشر عقب موت جلسنگر بوجوب مراقبةٍ عن كثب لجميع المشتركين في التجارب السريرية، من أجل فهم ردود الفعل السميّة، وذلك قبل تسريب الڤيروسات العلاجية وبعده. كما يشترط وجوب تحري المتطوعين جميعًا بحثًا عن أية عوامل مؤهِّبة يمكنها أن تزيد تحسسهم تجاه الڤيروسات.
|
ولقد أنجز عدد من فرق الأبحاث وشركات التقانة الحيوية هندسة ڤيروسات غدّية لا تستطيع صنع محصرات blockers پروتين ورم أرومة الشبكية Rb أو الپروتين 533. إن الخلايا السوية، التي تصنع هذه المحصرات، ستوقف تنسُّخ هذه الڤيروسات عن طريق كبحها الانقسام الخلوي. بيد أن هذه الڤيروسات ستتنسّخ في الخلايا التي تعطَّل فيها پروتين ورم أرومة الشبكية أو الپروتين 53 سلفًا ـ أي خلايا السرطان ـ وتقتلها. ويضع كورييل خططًا لإجراء تجارب سريرية على هذه الطريقة لمعالجة سرطان المبيض.
ويقوم الباحثون أيضًا بتزويد الڤيروسات العلاجية بجينات تجعل الخلايا التي تعديها مستعدة على نحو فريد لتقبّل المداواة الكيميائية. وتقتضي هذه التقنية وصلاً بين الڤيروسات وبين جينات تكوِّد الإنزيمات التي تحول الطلائع غير السّامّة، أو «طلائع الأدوية» إلى معالجات كيميائية مؤذية. وفي مثال ورد ذكره عام 2002، صمَّم <A.ليبر> والعاملون معه [من جامعة واشنطن] ڤيروسات غدّيّة لحمل الجينات المكوِّدة للإنزيمات القادرة على تحويل طلائع الأدوية غير المؤذية إلى مركبات كامبتوثيسين و 5 -فلوروأوراسيل المضادة للسرطان. وأجرى العلماء هندسة جينية للڤيروسات بحيث تستطيع صنع الإنزيمات في الخلايا النشيطة الانقسام فحسب، كالخلايا السرطانية. وحينما حقنوا الڤيروسات وطلائع الأدوية في الفئران التي زُرعت فيها خلايا بشرية من سرطان القولون أو الرحم، وجدوا أن الڤيروسات تكاثرت وانتشرت في الأورام.
شركات مختارة تعمل في مجال المداواة الڤيروسية (*********)
وتُعدُّ هذه الأنماط من المداواة الڤيروسية «الذكية» طليعة المداواة في المستقبل. ولكن ستبرز أمام الأطباء أيضًا ضرورة اقتفاء أثر فعالية المعالجات الڤيروسية في جسم المريض لإجراء أفضل تقييم لمدى نجاح تلك الاستراتيجيات وتشذيبها فيما بعد. ويعمل اختصاصيو المداواة الڤيروسية الآن متضافرين مع أطباء الأشعة لإرساء قواعد تقانات تصويرٍ جديدة تقيس بسهولة مقدار تنسُّخ الڤيروسات وفاعلية المداواة بها.
وتشمل استراتيجيات التصوير غرز جينة تتحكم في إنتاج جُزيء قائفtracer molecule ضمن ڤيروس أو ضمن خلية مصابة بڤيروس. وهذا الجزيء القائف إمّا أن يكون پروتينًا متألّقًا يُلاحَظ مباشرة، أو پروتينًا يرتبط سريعًا بنيكليوتيدات (بنُوَيْداتٍ) مشعَّة radionuclides تُستَخدم في تقنيات التصوير الشعاعي المعياري. وربما استطاع الپروتين المتألّق أن يعمل على أفضل وجه في السرطانات التي يمكن الوصول إليها بوساطة المنظار الداخلي، كسرطان الحنجرة. وباستعمالهم هذا المنظار، نجح الأطباء في رؤية مكان وجود الڤيروسات بدقة ـ ومن ثمّ الخلايا السرطانية ـ معتمدين في ذلك على البحث عن التألّق. ولكن لم تثبت هذه الطريقة نجاعتها حتى الآن إلاّ في الڤيروسات التي لا تقتل الخلايا. ومع ذلك، إنّنا على يقين بأن مثل هذه التقانات التصويرية المعقدة ستمكّن العلماء من استخلاص نتائج مهمة من التجارب السريرية التي ستُجرى في المستقبل على المداواة الڤيروسية.
وفي عام 1995 تنبأ رائد المداواة الجينية <F.W.أندرسون> [من كلية الطب في جامعة ساوث كاليفورنيا] حينما نشر في مجلة ساينتفيك أمريكان أنه «بحلول عام 2000…. ستصبح النسخ الأولى من النواقل القابلة للحقن، التي تستهدف خلايا معينة، متوافرة في التجارب السريرية.» وقد بدأ في الواقع إجراء هذه التجارب وفق الخطة الموضوعة، إضافة إلى تجارب أخرى لم يكن بإمكانه تصورها آنذاك. ونحن نتوقع أن تؤدي الڤيروسات دورًا مهمًا في كونها ڤيروسات علاجية في طب القرن الحادي والعشرين.
المؤلف
Dirk M. Nettelbeck – David T. Curiel
بدآ تعاونهما في مركز المداواة الجينية بجامعة ألاباما في برمنگهام [UAB]، حيث يعمل كورييل مديرًا لقسم المداواة الجينية البشرية. وكورييل، الذي يحمل الدكتوراه في الطب والدكتوراه في العلوم، هو رئيس قسم جين وآن گريفّن لأبحاث سرطان النساء في جامعة ألاباما، كما أنه أستاذ المداواة الجينية في الجامعة الحرة في أمستردام. أما نتِّلبك ـ الذي يرأس الآن فريق بحث يركّز على المعالجة الڤيروسية للملانوم (الورم الملاني) الخبيث في قسم الأمراض الجلدية بجامعة إرلانگن نورمبرگ بألمانيا ـ فكان اختصاصيًا في البيولوجيا الجزيئية وزميل ما بعد الدكتوراه في جمعية الأبحاث الألمانية بجامعة ألاباما بين عامي 2000 و2003. وقد حصل على الدكتوراه في العلوم عامي 2000 من جامعة فيليپس في ماربورگ بألمانيا، وكُرِّم بجائزة تخرُّجٍ من قبل مؤسسة نوڤاريتس للأبحاث العلاجية.
مراجع للاستزادة
Gene Therapy; Designer Promoters for TumourTargetlng.
D. M. Nettelbeck, V. Jerome and R. Muller in Trends in Genetics, Vol. 16, pages 174-181; 2000.
Replicative Adenoviruses for Cancer Therapy. R. Alemany, C. Balagu€ and D. T. Curiel in Nature Biotechnology, Vol. 18, pages 723-727; 2000. Vector Targeting for Therapeutic Gene Delivery. Edited by D. T. Curiel and J. T. Douglas. John Wiley A: Sons, 2002.
Cytolytic Viruses as Potential Anti-Cancer Agents. C.J.A. Ring in Journal of General Virology, Vol. 83, pages 491-502; 2002. Gene therapy clinical trials database of Journal of Gene Medicine:
www.wtley.com/legacy/wileychl/genmed/clinical/ , American Society of Gene Therapy: www.asgt.org
Scientific American, October 2003
(*) TUMOR-BUSTING VIRUSES
(**) Overview/ Anticancer Viruses
(***)Viruses to the Rescue?
(****) Homing In on the Target
(*****) Targeling Melanoma
(******) Other Strategies
(*******) Zapping Cancer Cells with Viruses
(********)But Is It Safe?
(*********) Selected Companies Involved in Virotherapy
( drift away (1
(2)protrusions
(3) inherited disorder
(4) التنبيغ transduction هو انتقال شُدفةِ دنا DNA من حي ميكروي إلى آخر. (التحرير)