تحت المجهر: فوائد سلامة الأفيونيات ’المتحيزة’
تتحدى دراسات أُجريت على الفئران فرضية نجاح الجهود المبذولة للحد من الآثار الجانبية المميتة لمسكنات الألم
بقلم: كيلي سيرفيك
ترجمة: صفاء كنج
إن الجانب المظلم في قدرة المواد الأفيونية على تهدئة الألم هو احتمال أن تقتل مستخدمها. ويمكن لمستقبلات الدماغ نفسها التي تخفف الألم عندما ترتبط بعقاقير مثل المورفين أو أكسيكودون Oxycodone أن ترسل إشارة لإبطاء التنفس. وتثبيط التنفس هذا هو الذي يسبب معظم الوفيات الناجمة عن جرعة زائدة.
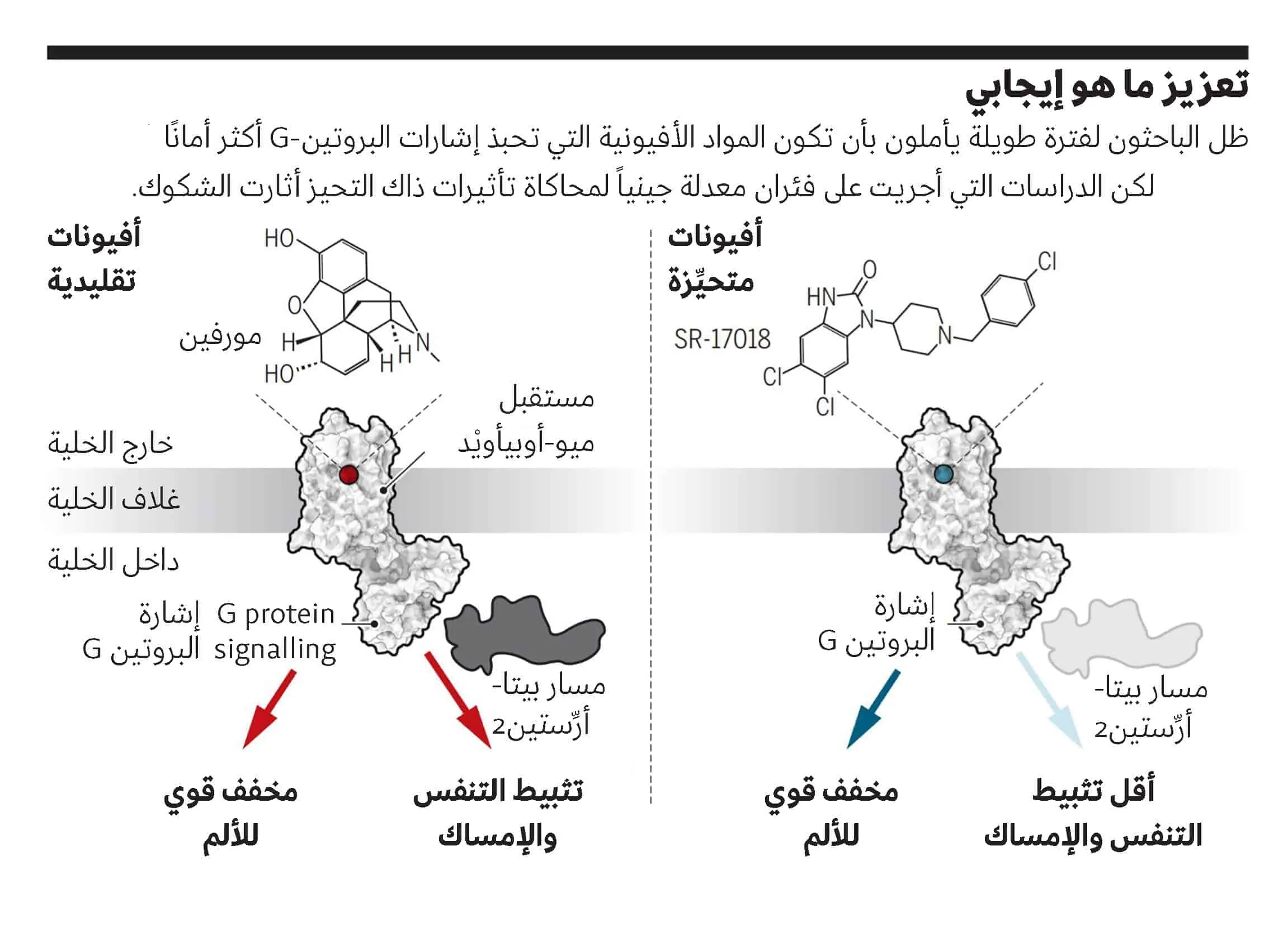
لذا، فقد أمل العلماء بتصميم عقارات أفيونية “متحيِّزة” Biased تجاه تنشيط إشارات تسكين الألم من دون المساس بإشارات الجهاز التنفسي. وقد عمل العديد من الشركات على تطوير واختبار المواد الأفيونية المتحيِّزة (Science, 17 November 2017, p. 847).
ولكن دراستين جديدتين أجريتا على الفئران تتحديان فرضية أساسية تكمن وراء هذه الجهود – وهي أن البروتين المرسل للإشارات المسمى بيتا-أرِّستين 2 (Beta-arrestin2) أساسي في تأثير المواد الأفيونية في التنفس.
ويقول غاسبار مونتاندون Gaspard Montandon، اختصاصي علم الأعصاب وفيسيولوجيا التنفس من جامعة تورونتو University of Toronto: “يبدو أن الفرضية كانت خطأ”. ويشك مونتاندون وآخرون في إمكانية فك التشابك بين الآثار الجيدة للأفيونيات ومضارها.
وظهرت الآمال الأولى في أواخر تسعينات القرن العشرين وأوائل الألفية الثانية، عندما استكشفت اختصاصية علم الأعصاب لورا بون Laura Bohn، واختصاصي الكيمياء الحيوية روبرت ليفكوفيتش Robert Lefkowitz، وزملاؤهما من جامعة ديوك Duke University سلاسل متتالية من الإشارات التي تحدث عندما يرتبط الدواء بمستقبلات ميو-أوبيأويْد Mu-opioid على الخلايا العصبية. ويغير هذا الارتباط بنية المستقبِل وتفاعلاته مع نوعين من البروتينات داخل الخلية – يشيران إلى جزيئات تُعرف بالبروتينات G G-proteins وبيتا-أرِّستين Beta-arrestins التي، تمنع، من بين تأثيرات أخرى، البروتين جي من إرسال إشارة.
ولا يزال من غير الواضح الكيفية التي تؤثر بها الإشارات المتتالية الناتجة في الخلايا أو دارات المخ Brain circuits. ولكن الباحثين أفادوا في عام 1999 أن الفئران التي عُدلت لتفتقر إلى الجين الخاص ببيتا- آريستين2 حصلت بفضل المورفين على تأثير أقوى وأطول في تخفيف الألم. وفي عام 2005 وجدت بون وزملاؤها أن اثنين من الآثار الجانبية الناجمة عن المورفين وهما الإمساك وتباطؤ التنفس، انخفضت بشكل كبير في هذه الفئران “المعطَّلة الجين” Knockout. وتقترح النتائج أن دواء قادراً على دفع المستقبلات ميو-أوبيأويْد نحو تحبيذ إشارات البروتين-جي وبعيدًا عن إشارات بيتا-أرِّستين2 قد يكون له مفعول أقوى في تخفيف الألم مع تقليل المخاطر.
تبع ذلك إقبال على البحث عن مواد أفيونية متحيِّزة. وكانت شركة تريفينا Trevena من أبرز السباقين للعمل على طرح دواء في السوق، إذ اختبرت الدواء المرشح أوليسيريدين Oliceridine الذي يُعطى عن طريق الوريد لتخفيف الألم بعد الجراحة. ولكن في الجرعات العالية فشل المركَّب في إظهار أن تأثيره أفضل بكثير من المورفين من حيث سلامة التنفس. وفي عام 2018 رفضت إدارة الغذاء والدواء الأمريكية Food and Drug Administration اعتماد أوليسريدين. وأعادت تريفينا تقديم طلبها مع بيانات إضافية في شهر فبراير 2020.
ولكن بعض الباحثين يشككون في التجارب التي أجريت على الفئران وكانت وراء السعي إلى تطوير أدوية على أساسها. ففي عام 2019، وفي مجلة نيتشر كوميونيكشنز Nature Communications، وصفت مجموعة تضم اختصاصيَّ علم الصيدلة أندريا كليفر Andrea Kliewer وستيفان شولتز Stefan Schulz من جامعة فريدريتش شيلر Friedrich Schiller في ينا بألمانيا تجارب أجريت على الفئران الحاملة لطفرات في جين مستقبلات الأفيونيات ميو-أوبيأويْد منعت المستقبِل من التفاعل مع بيتا-أرِّستين2. لدى إعطائها المورفين أصيبت هذه الحيوانات بالإمساك وثبّط العقارُ تنفسَها في بعض الأحيان بدرجة أكثر حدة من الفئران غير المعدلة لتحمل تلك الطفرة.
ومنذ ذلك الحين، فقد حاول فريق يِنا ومختبرات في بريستول بالمملكة المتحدة وسيدني تكرار اكتشاف عام 2005 بأن استخدموا مباشرة فئرانًا عُطل لديها الجين المرتبط ببيتا-أرِّستين2. ولاحظت المختبرات الثلاثة الإمساك الناجم عن المواد الأفيونية وآثاراً جانبية في التنفس مماثلة لتلك التي لوحظت لدى الفئران القادرة على إنتاج بيتا-أرِّستين2. (Arrestin2). وتقول أندريا كليفر إن الفكرة القائلة أن المواد الأفيونية المتحيِّزة مع البروتين G ستوفر درجة أعلى من الأمان كانت “سهلة أكثر مما يجب”.
ويقول تشارلز شافكين Charles Chavkin، اختصاصي علم الأدوية من جامعة واشنطن University of Washington في سياتل، إن النتائج التي نشرت في 12 فبراير 2020 في المجلة البريطانية لعلم الصيدلة British Journal of Pharmacology “مقنعة جداً”. ويقول إنه من غير المرجح أن تعتمد الآثار الجانبية للمواد الأفيونية فقط على بيتا-آريستين2.
ولعل أبسط تفسير لنتائج 2005 و2020 المتضاربة هو أن الفئران كانت مختلفة جينياً. إذ كانت الفئران في الدراسات الأولية خليطاً من سلالات متعددة. وربما أدى التزواج والتهجين إلى تغيير طريقة استجابتها للأفيونيات. وتقول بون التي تعمل حالياً في شركة سكريبس ريسيرتش Scripps Research: “لدي ثقة كبيرة في البيانات المبكرة. … لا توجد وسيلة للعودة إلى الوراء والحصول على الحيوانات نفسها التي كانت لدينا قبل 20 عاما”.
وتقول بون إن المصالح التجارية “بالغت في الإشادة (بالنتائج الأصلية التي توصلت إليها) وفي تبسيطها”. وتضيف أن “البروتينات G لا يمثل الخير فحسب كما أن بيتا لا تمثل الشر فحسب”. فقد كانت الفئران المعطلة الجين بيتا-أرِّستين2 نقطة انطلاق مهمة، كما تقول، لكنها نموذج غير مثالي للاستجابة للدواء، ويرجع ذلك جزئيًا إلى أنها ربما تمكنت من تعويض هذا البروتين الرئيسي بطريقة ما لتبقى حية. ويقوم فريقها حالياً بإعداد مواد أفيونية متحيِّزة جديدة ومقارنتها بالمواد الأفيونية التقليدية في تجارب على الحيوانات تقيس تثبيط التنفس والآثار السلبية الأخرى مثل تطوير القدرة على التحمل والإدمان.
ويقول براين روث Bryan Roth، اختصاصي علم الأدوية الجزيئية من جامعة نورث كارولاينا University of North Carolina، في تشابل هيل، الذي ساعد على تطوير مادة أفيونية متحيِّزة تُعرف بـ PZM21 ويحتفظ بمخزون منها لدى شركة رخَّصتها: “أعتقد بصحة كلتا مجموعتي البيانات، لأن الفريقين حريصان في عملهما”. وحل مسألة الدور الذي يؤديه بيتا-أرِّستين2 سيتطلب تركيب مزيد من الأفيونيات المتحيِّزة بقوة، كما يقول. ويضيف أيضًا: “إذا كانت فرضية [المواد الأفيونية المتحيِّزة] صحيحة؛ فسيكون ذلك مفيدًا جدا للجنس البشري Human race. … إنها فرضية يجدر اختبارها”.
© 2020, American Association for the Advancement of Science. All rights reserved.